题目内容
15.根据下列实验装置回答: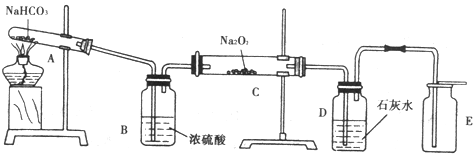
(1)A中反应的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(2)B中浓硫酸的作用是干燥CO2气体,吸收水蒸气;
(3)C中的现象是淡黄色固体变为白色;化学方程式2Na2O2+2CO2=2Na2CO3+O2;
(4)D的作用是吸收未反应的CO2气体.
(5)E中收集的气体是O2.
分析 分析装置图可知装置中的大试管A中是碳酸氢钠受热分解得到二氧化碳气体,气体中混入水蒸气,通过装置B中的浓硫酸干燥除去,通过装置C和过氧化钠反应生成碳酸钠和氧气,再通过装置D中的石灰水除去未反应的二氧化碳气体,最后用向上排空气法收集氧气,
(1)装置分析可知A中是碳酸氢钠受热分解的反应,反应生成碳酸钠、二氧化碳和水;
(2)装置B中浓硫酸可以除去二氧化碳气体中的水蒸气;
(3)装置C中 是二氧化碳和过氧化钠反应生成碳酸钠和氧气,固体颜色淡黄色变化为白色;
(4)装置D中的石灰水是除去气体中的二氧化碳气体;
(5)装置E中是用向上排气法收集得到生成的氧气.
解答 解:(1)A中是碳酸氢钠受热分解的反应,反应生成碳酸钠、二氧化碳和水的反应,化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(2)装置B中浓硫酸可以除去二氧化碳气体中的水蒸气,起到干燥CO2气体,吸收水蒸气的作用,
故答案为:干燥CO2气体,吸收水蒸气;
(3)装置C中 是二氧化碳和过氧化钠反应生成碳酸钠和氧气,固体颜色淡黄色变化为白色,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:淡黄色固体变为白色,2Na2O2+2CO2=2Na2CO3+O2;
(4)装置D中的石灰水是除去气体中的二氧化碳气体,Ca(OH)2+CO2=CaCO3↓+H2O,通过石灰水吸收未反应的二氧化碳气体,
故答案为:吸收未反应的CO2气体;
(5)上述分析可知,装置E中是用向上排气法收集气体,是反应生成的氧气O2,
故答案为:O2.
点评 本题考查了实验装置和物质性质的分析,主要是试剂作用和发生反应的产物除杂、提纯、收集等,题目较简单.

| A. | 单质沸点:X>Y | B. | 阳离子的氧化性:W>Y | ||
| C. | 氧化物的水化物的酸性:Z>X | D. | Y、Z的简单离子均能抑制水的电离 |
| A. | 不变 | B. | 增大 | C. | 减小 | D. | 无法判断 |
 关于确定是(Ⅱ)而不是(Ⅰ),下列说法正确的是( )
关于确定是(Ⅱ)而不是(Ⅰ),下列说法正确的是( )| A. | 乙醇可以用来制饮料 | |
| B. | 1 mol乙醇完全燃烧时生成3mol水 | |
| C. | 1mol乙醇与足量的钠作用生成1g H2 | |
| D. | 物质的量相同的乙醇和乙烯气体完全燃烧,耗氧量相同 |
| A. | 乙醇、糖类和蛋白质都是人体必需的营养物质 | |
| B. | 福尔马林可防腐,可用它保存海鲜产品 | |
| C. | 油脂在酸性条件下水解生成高级脂肪酸和甘油 | |
| D. | 合成橡胶与光导纤维属于有机高分子材料 |
| A. | 用稀氨水鉴别Al3+、Mg2+和Ag+ | |
| B. | 用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 | |
| C. | 用酸性KMnO4溶液鉴别CH3CH═CHCH2OH和CH3CH2CH2CHO | |
| D. | 用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32- |
| A. | 汽油、甘油和四氯化碳 | B. | 葡萄糖、蔗糖和纯碱 | ||
| C. | 溴蒸气和二氧化氮 | D. | 碘和高锰酸钾 |