题目内容
19.下列离子方程式不正确的是( )| A. | 向100mL0.1mol•L-1的Na2CO3溶液中滴加含0.01molCH3COOH的醋酸溶液CO32-+CH3COOH═HCO3-+CH3COO- | |
| B. | 4mol•L-1的NaAlO2溶液和7mol•L-1的盐酸等体积均匀混合4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ | |
| C. | 等物质的量的FeBr2与Cl2反应(已知:Br2+2Fe2+═2Fe3++2 Br-,Cl2+2Br-═Br2+2Cl-):2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 向NaAlO2溶液中通入过量CO2的反应:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
分析 A.碳酸钠的物质的量为0.01mol,二者恰好反应生成碳酸氢钠和醋酸钠;
B.设溶液体积为1L,则偏铝酸钠的物质的量为4mol,HCl的物质的量为7mol,4mol偏铝酸钠消耗4mol HCl生成4mol氢氧化铝,剩余的3molHCl能够溶解1mol氢氧化铝,则反应生成氢氧化铝与铝离子的物质的量之比为3:1;
C.亚铁离子还原性大于溴离子,设物质的量都是1mol,1mol亚铁离子消耗0.5mol氯气,剩余的0.5mol氯气消耗1mol溴离子;
D.二氧化碳过量,反应生成氢氧化铝沉淀和碳酸氢钠.
解答 解:A.100mL0.1mol•L-1的Na2CO3溶液中含有溶质碳酸钠的物质的量为:0.1mol/L×0.1L=0.01mol,0.01mol碳酸钠与0.01molCH3COOH的醋酸溶液反应生成醋酸钠和碳酸氢钠,反应的离子方程式为:CO32-+CH3COOH═HCO3-+CH3COO-,故A正确;
B.4mol•L-1的NaAlO2溶液和7mol•L-1的盐酸等体积均匀混合,可设溶液体积为1L,则溶液中含有NaAlO2的物质的量为4mol,含有HCl的物质的量为7mol,4molNaAlO2消耗4mol HCl生成4mol氢氧化铝,剩余的3molHCl能够溶解1mol氢氧化铝,则反应生成氢氧化铝与铝离子的物质的量之比为3:1,反应的离子方程式为:4AlO2-+7H++H2O═3Al(OH)3↓+Al3+,故B正确;
C.等物质的量的FeBr2与Cl2反应,设二者物质的量都是1mol,亚铁离子优先被氧化,1mol亚铁离子消耗0.5mol氯气,剩余的0.5mol氯气消耗1mol溴离子,反应的离子方程式为:Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-,故C正确;
D.NaAlO2溶液中通入过量CO2,反应生成氢氧化铝沉淀和碳酸氢钠,正确的离子方程式为:AlO2-+CO2+3H2O═Al(OH)3↓+HCO3-,故D错误;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,试题侧重考查反应物过量情况对生成物的影响,试题培养了学生的分析能力及灵活应用能力.

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案| A. | 在潮湿的环境中,铜容易发生析氢腐蚀形成铜绿 | |
| B. | 常温下,将pH=4的醋酸溶液稀释后,电离平衡右移,所有离子的浓度均降低 | |
| C. | 反应SiO2(s)3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 | |
| D. | 等体积、等物质的量浓度的NH3•H2O溶液与NH4Cl溶液混合后溶液呈碱性,说明NH3•H2O的电离程度大于NH${\;}_{4}^{+}$的水解程度 |
| A. | c(Na+)=c(CH3COO-) | B. | pH>7 | C. | pH=7 | D. | pH<7 |
| A. | Pb(NO3)2是反应物;HNO3是生成物 | B. | HMnO4是反应物;MnSO4是生成物 | ||
| C. | HNO3是反应物;H2O是生成物 | D. | H2O是反应物;HMnO4是生成物 |
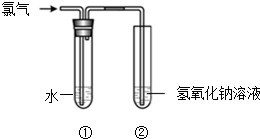 某同学用图所示装置制取氯水并进行相关实验.
某同学用图所示装置制取氯水并进行相关实验.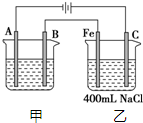 如图所示为相互串联的甲、乙两电解池.试回答:
如图所示为相互串联的甲、乙两电解池.试回答: