题目内容
7.已知:25℃时0.lmol•L-lNaHC2O4溶液的pH=5.5,对该溶液判断不正确的是( )| A. | 25℃时加入等体积等浓度的NaOH溶液后溶液的pH一定大于7 | |
| B. | c(C2O42- )<c( OH-) | |
| C. | c(Na+)+c(H+)>c(C2O42- )+c( HC2O4-)+c( OH-) | |
| D. | c(Na+)>c( HC2O4-)>c(H2C2O4)>c(C2O42- ) |
分析 已知:25℃时0.lmol•L-lNaHC2O4溶液的pH=5.5,溶液显酸性说明HC2O4-电离程度大于其水解程度,
A.25℃时加入等体积等浓度的NaOH溶液后恰好完全反应生成草酸钠,草酸根离子水解溶液显碱性;
B.溶液显酸性说明HC2O4-电离程度大于其水解程度;
C.溶液中存在电荷守恒分析判断;
D.溶液显酸性说明HC2O4-电离大于其水解程度,据此分析离子浓度大小.
解答 解:A.25℃时加入等体积等浓度的NaOH溶液后恰好完全反应生成草酸钠,草酸根离子水解溶液显碱性,25℃时加入等体积等浓度的NaOH溶液后溶液的pH一定大于7,故A正确;
B.溶液显酸性说明HC2O4-电离程度大于其水解程度,c(C2O42- )>c( OH-),故B错误;
C.溶液中存在电荷守恒,c(Na+)+c(H+)=2c(C2O42- )+c( HC2O4-)+c( OH-),故C错误;
D.溶液显酸性说明HC2O4-电离大于其水解程度,溶液中离子浓度大小,c(Na+)>c( HC2O4-)>c(C2O42- )>c(H2C2O4),故D错误;
故选A.
点评 本题考查盐类水解、弱电解质电离平衡的影响因素、电解质溶液中电荷守恒判断以及离子浓度大小比较知识,注意盐的水解原理的应用是重点,题目难度中等.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
16.下列说法错误的是( )
| A. | 在过渡元素中寻找优良的催化剂 | |
| B. | 由元素周期律HC1O4可以类推出氟元素也存在最高价氧化物的水化物HFO4 | |
| C. | 在元素周期表的金属和非金属分界线附近寻找半导体材料 | |
| D. | 在化工生产中应遵循“绿色化学”的思想 |
18.糖类、油脂和蛋白质是人体不可缺少的营养物质,下列有关叙述正确的是( )
| A. | 所有的蛋白质均可通过颜色反应来鉴别 | |
| B. | 淀粉和纤维素表达式为(C6H10O5)n,互为同分异构体 | |
| C. | 糖类、油脂、蛋白质均有C、H、O三种元素组成 | |
| D. | 油脂在碱性条件下水解生成甘油和高级脂肪酸盐 |
2.下列有机反应属于同一反应类型的是( )
| A. | 甲烷制一氯甲烷、苯制溴苯 | |
| B. | 乙醇制乙醛、乙醇和乙酸制乙酸乙酯 | |
| C. | 乙醇制乙烯、乙烯制乙醇 | |
| D. | 苯制环己烷、乙酸乙酯水解 |
4.a 实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+
(滴定时,1mol (CH2)6N4H+与1mol H+相当),然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500g.
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①选用滴定管为乙(填“甲”或“乙”).

②碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”);锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察.
A.滴定管内液面的变化B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变成红色.
(2)滴定结果如下表所示:
若NaOH标准溶液的浓度为0.1010mo1•L-1,则该样品中氮的质量分数为18.85%.
b 在测定中和热的实验中,下列说法正确的是A
A.使用环形玻璃棒是为了加快反应速率,减小实验误差
B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C.用0.5mol•L-1NaOH溶液分别与0.5 mol•L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同
D.在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、滴定管、温度计.
(滴定时,1mol (CH2)6N4H+与1mol H+相当),然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500g.
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①选用滴定管为乙(填“甲”或“乙”).

②碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数偏高(填“偏高”、“偏低”或“无影响”);锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察.
A.滴定管内液面的变化B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变成红色.
(2)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
b 在测定中和热的实验中,下列说法正确的是A
A.使用环形玻璃棒是为了加快反应速率,减小实验误差
B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C.用0.5mol•L-1NaOH溶液分别与0.5 mol•L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同
D.在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、滴定管、温度计.
8.氢氧燃料电池已用于航天飞机.以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:2H2+4OH--4e-═4H2O;O2+2H2O+4e-═4OH- 据此作出判断,下列说法中正确的是( )
| A. | O2在正极发生氧化反应 | |
| B. | 燃料电池的能量转化率可达100% | |
| C. | 工作一段时间后电解质溶液中OH-的物质的量浓度增大 | |
| D. | 产物为无污染的水,属于环境友好电池 |
9.某同主族(或同周期)元素的主要化合价的变化规律如图所示,它们可能位于周期表( )


| A. | ⅠA族 | B. | ⅡA族 | C. | 第二周期 | D. | 第三周期 |
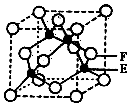 A、B、C、D、E、F是元素周期表前四周期中的常见元素,原子序数依次增大.A的原子半径在周期表中最小,B原子核外电子有6种不同的运动状态.C元素原子的最外层电子数是次外层电子数的3倍.D元素第一电离能至第四电离能分别是I1=578kJ/mol、I2=1817kJ/mol、I3=2745kJ/mol、I4=11575kJ/mol.E与B可形成正四面体形分子.F的一种同位素的质量数为63,中子数为34.回答下列问题:
A、B、C、D、E、F是元素周期表前四周期中的常见元素,原子序数依次增大.A的原子半径在周期表中最小,B原子核外电子有6种不同的运动状态.C元素原子的最外层电子数是次外层电子数的3倍.D元素第一电离能至第四电离能分别是I1=578kJ/mol、I2=1817kJ/mol、I3=2745kJ/mol、I4=11575kJ/mol.E与B可形成正四面体形分子.F的一种同位素的质量数为63,中子数为34.回答下列问题: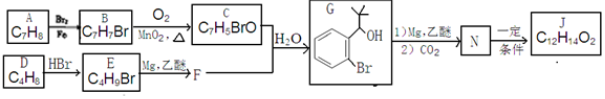

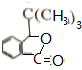 .
.
 反应①的反应条件和试剂分别为光照、Br2;L的结构简式为
反应①的反应条件和试剂分别为光照、Br2;L的结构简式为 .
.