题目内容
下列离子方程式中,正确的是( )
| A、向氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- |
| B、将氯气通入KI溶液中:Cl2+2I-═2Cl-+I2 |
| C、将氯气通入水中:Cl2+H2O═Cl-+ClO-+2H+ |
| D、将锌粒投入稀硝酸中:Zn+2H+=Zn2++H2↑ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.根据电荷守恒判断,该离子方程式两边电荷不守恒;
B.氯气氧化性大于碘单质,氯气与碘离子反应生成碘单质和氯离子;
C.次氯酸为弱电解质,离子方程式中次氯酸不能拆开;
D.稀硝酸为强氧化性的酸,锌与稀硝酸反应生成一氧化氮气体,不会生成氢气.
B.氯气氧化性大于碘单质,氯气与碘离子反应生成碘单质和氯离子;
C.次氯酸为弱电解质,离子方程式中次氯酸不能拆开;
D.稀硝酸为强氧化性的酸,锌与稀硝酸反应生成一氧化氮气体,不会生成氢气.
解答:
解:A.向氯化亚铁溶液中通入氯气,离子方程式必须满足电荷守恒,正确的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故A错误;
B.将氯气通入KI溶液中,反应生成碘单质和氯离子,反应的离子方程式为:Cl2+2I-═2Cl-+I2,故B正确;
C.氯气和水反应生成氯化氢和次氯酸,次氯酸应该保留分子式,正确的离子方程式为:Cl2+H2O=H++Cl-+HClO,故C错误;
D.将锌粒投入稀硝酸中,反应生成硝酸锌、一氧化氮气体和水,不会生成氢气,正确的离子方程式为:3Zn+8H++2NO3-═3Zn2++2NO↑+4H2O,故D错误;
故选B.
B.将氯气通入KI溶液中,反应生成碘单质和氯离子,反应的离子方程式为:Cl2+2I-═2Cl-+I2,故B正确;
C.氯气和水反应生成氯化氢和次氯酸,次氯酸应该保留分子式,正确的离子方程式为:Cl2+H2O=H++Cl-+HClO,故C错误;
D.将锌粒投入稀硝酸中,反应生成硝酸锌、一氧化氮气体和水,不会生成氢气,正确的离子方程式为:3Zn+8H++2NO3-═3Zn2++2NO↑+4H2O,故D错误;
故选B.
点评:本题考查了离子方程式的正误判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列反应的离子方程式书写正确的是( )
| A、氢氧化镁与稀硫酸反应 H++OH-=H2O |
| B、钠与水的反应 Na+2H2O=Na++2OH-+H2↑ |
| C、碳酸钙溶于醋酸CaCO3+2H+=Ca2++CO2↑+H2O |
| D、用氢氧化钠溶液吸收少量二氧化碳2OH-+CO2=CO32-+H2O |
下列物质中,能使溴水褪色的是( )
| A、聚乙烯 |
| B、KI溶液 |
| C、SO2 |
| D、乙醇 |
向盛有乙醇的烧杯中投入一小块金属钠,可以观察到的现象是( )
| A、钠块一直浮在乙醇液面上 |
| B、钠块很快熔化成光亮的钠球 |
| C、比钠与水的反应激烈得多 |
| D、钠块表面有气泡产生 |
下列实验中所选用的仪器合理的是( )
| A、用200mL量筒量取5.2mL稀硫酸 |
| B、用250mL容量瓶配制250mL0.2mol/L的氢氧化钠溶液 |
| C、用托盘天平称量11.75g氯化钠晶体 |
| D、用碱式滴定管量取25.10mL溴水 |
下列有关仪器的使用正确的是( )
| A、手持试管给试管内的物质加热 |
| B、用燃着的酒精灯去点燃另一盏酒精灯 |
| C、用天平称量药品时用手直接拿砝码 |
| D、配制一定物质的量浓度溶液时,取完浓溶液的量筒不需要洗涤 |
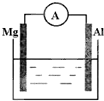 如图所示,组成一个原电池.
如图所示,组成一个原电池.