题目内容
 氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:
氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:| 温度/℃ | 200 | 300 | 400 | 500 | 600 |
| 氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
(1)根据表中数据分析,该反应是
(2)在一定温度下,将2mol N2和6mol H2通入到体积为2L的密闭容器中,发生反应N2+3H2?2NH3,2min达到平衡状态时,H2转化率是50%,该温度下的平衡常数K=
(3)从化学平衡移动的角度分析,提高H2转化率可以采取的措施是
a、及时分离出NH3
b、升高温度
c、增大压强
d、使用催化剂
(4)NH3也能分解为N2和H2,在相同条件下,测得分解后混合气体密度为分解前的
| 2 |
| 3 |
(5)根据图的能量变化,求下列反应的反应热.
N2(g)+3H2(g)?2NH3(l)△H=
考点:化学平衡的影响因素,用盖斯定律进行有关反应热的计算,化学平衡的计算
专题:化学平衡专题
分析:(1)依据图表数据分析判断,平衡常数随温度升高减小,说明升温平衡逆向进行,正反应为放热反应;
(2)依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算,平衡常数随温度变化;
(3)提高H2转化率可以采取的措施,平衡正向进行,结合平衡移动原理分析判断;
(4)相同条件下,密度之比等于摩尔质量之比,混合气体总质量不变,分解后混合气体密度为分解前的
,则分解后混合气体总物质的量为分解前的
倍,假设分解前NH3为1mol,发生分解的NH3为xmol,根据方程式进行计算解答;
(5)图象分析结合热化学方程式书写方法写出,标注物质聚集状态和对应反应的焓变,生成1mol液态氨气放热(a-b-c)KJ.
(2)依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算,平衡常数随温度变化;
(3)提高H2转化率可以采取的措施,平衡正向进行,结合平衡移动原理分析判断;
(4)相同条件下,密度之比等于摩尔质量之比,混合气体总质量不变,分解后混合气体密度为分解前的
| 2 |
| 3 |
| 3 |
| 2 |
(5)图象分析结合热化学方程式书写方法写出,标注物质聚集状态和对应反应的焓变,生成1mol液态氨气放热(a-b-c)KJ.
解答:
解:(1)图表数据分析判断,平衡常数随温度升高减小,说明升温平衡逆向进行,正反应为放热反应,故答案为:放热;
(2)2min达到平衡状态时,H2转化率是50%,则消耗的H2的物质的量为3mol,
N2 +3H2 ?2NH3,
开始(mol/L):1 3 0
变化(mol/L):0.5 1.5 1
平衡(mol/L):0.5 1.5 1
答:H2的平均反应速率为3mol∕L.s.
化学平衡常数K=
=
=
;
俗使K增大,则平衡正向移动,而该反应为放热反应,所以降低温度,平衡向放热的方向移动,即正向移动,
故答案为:
;降低温度;
(3)反应为N2+3H2?2NH3 △H<0,提高H2转化率,应使平衡向正反应方向移动,则
a.及时分离出NH3,平衡正向移动,H2转化率提高,故a正确;
b.升高温度,平衡向吸热的方向移动,即逆反应方向移动,H2转化率降低,故b错误;
c.增大压强,平衡向气体体积减少的方向移动,即正向移动,H2转化率提高,故c正确;
d.使用催化剂,平衡不移动,H2转化率不变,故d错误;
故选:ac;
(4)相同条件下,密度之比等于摩尔质量之比,混合气体总质量不变,分解后混合气体密度为分解前的
,则分解后混合气体总物质的量为分解前的
倍,假设分解前NH3为1mol,则分解后总物质的量=1mol×
=1.5mol,则:
2NH3=N2+3H2 物质的量增大
2 2
xmol 1.5mol-1mol=0.5mol
故2:2=xmol:0.5mol,解得x=0.5,
故氨气的分解率=
×100%=50%,
故答案为:50%;
(5)图象分析可知,生成1mol液态氨气放热(a-b-c)KJ,生成2mol氨气放热2(a-b-c)kJ,N2(g)+3H2(g)?2NH3(l)△H=2(a-b-c)kJ?mol-1;
故答案为:-2(b+c-a)kJ?mol-1或2(a-b-c)kJ?mol-1.
(2)2min达到平衡状态时,H2转化率是50%,则消耗的H2的物质的量为3mol,
N2 +3H2 ?2NH3,
开始(mol/L):1 3 0
变化(mol/L):0.5 1.5 1
平衡(mol/L):0.5 1.5 1
答:H2的平均反应速率为3mol∕L.s.
化学平衡常数K=
| c2(NH3) |
| c(N2)c3(H2) |
| 12 |
| 0.5×1.53 |
| 16 |
| 27 |
俗使K增大,则平衡正向移动,而该反应为放热反应,所以降低温度,平衡向放热的方向移动,即正向移动,
故答案为:
| 16 |
| 27 |
(3)反应为N2+3H2?2NH3 △H<0,提高H2转化率,应使平衡向正反应方向移动,则
a.及时分离出NH3,平衡正向移动,H2转化率提高,故a正确;
b.升高温度,平衡向吸热的方向移动,即逆反应方向移动,H2转化率降低,故b错误;
c.增大压强,平衡向气体体积减少的方向移动,即正向移动,H2转化率提高,故c正确;
d.使用催化剂,平衡不移动,H2转化率不变,故d错误;
故选:ac;
(4)相同条件下,密度之比等于摩尔质量之比,混合气体总质量不变,分解后混合气体密度为分解前的
| 2 |
| 3 |
| 3 |
| 2 |
| 3 |
| 2 |
2NH3=N2+3H2 物质的量增大
2 2
xmol 1.5mol-1mol=0.5mol
故2:2=xmol:0.5mol,解得x=0.5,
故氨气的分解率=
| 0.5mol |
| 1mol |
故答案为:50%;
(5)图象分析可知,生成1mol液态氨气放热(a-b-c)KJ,生成2mol氨气放热2(a-b-c)kJ,N2(g)+3H2(g)?2NH3(l)△H=2(a-b-c)kJ?mol-1;
故答案为:-2(b+c-a)kJ?mol-1或2(a-b-c)kJ?mol-1.
点评:本题考查热化学方程式有关计算,化学平衡计算应用,难度不大,根据密度关系确定分解恰好气体物质的量关系是关键.

练习册系列答案
相关题目
下列反应的离子方程式书写正确的是( )
| A、氢氧化镁与稀硫酸反应 H++OH-=H2O |
| B、钠与水的反应 Na+2H2O=Na++2OH-+H2↑ |
| C、碳酸钙溶于醋酸CaCO3+2H+=Ca2++CO2↑+H2O |
| D、用氢氧化钠溶液吸收少量二氧化碳2OH-+CO2=CO32-+H2O |
向盛有乙醇的烧杯中投入一小块金属钠,可以观察到的现象是( )
| A、钠块一直浮在乙醇液面上 |
| B、钠块很快熔化成光亮的钠球 |
| C、比钠与水的反应激烈得多 |
| D、钠块表面有气泡产生 |
将锌片和铜片用导线连接置于同一稀硫酸溶液中,下列各叙述正确的是( )
| A、正极附近SO42-的浓度逐渐增大 |
| B、负极附近SO42-的浓度逐渐减小 |
| C、负极附近SO42-的浓度逐渐增大 |
| D、正极附近SO42-的浓度基本不变 |
 将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.
将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.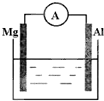 如图所示,组成一个原电池.
如图所示,组成一个原电池.