题目内容
6.对如图装置(铁的防护)的分析正确的是( )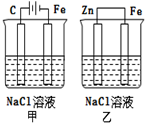
| A. | 甲装置是牺牲阳极的阴极保护法 | |
| B. | 乙装置是牺牲阳极的阴极保护法 | |
| C. | 一段时间后甲、乙装置中pH均增大 | |
| D. | 甲、乙装置中铁电极的电极反应式均为:2H++2e→H2↑ |
分析 甲装置中C为阳极,阳极上氯离子失电子,Fe为阴极,阴极上氢离子得电子;乙装置中Zn为负极,Fe为正极,正极上氧气得电子,据此分析.
解答 解:A.甲装置中C为阳极,阳极上氯离子失电子,Fe为阴极,阴极上氢离子得电子,属于外加电源的阴极保护法,故A错误;
B.乙装置中Zn为负极,Fe为正极,正极上氧气得电子,Fe不参加反应,Fe被保护,所以是牺牲阳极的阴极保护法,故B正确;
C.甲装置中电解氯化钠生成氢氧化钠,溶液的pH增大,乙装置中负极Zn失电子,正极氧气得电子,最终生成氢氧化锌,溶液的pH几乎不变,故C错误;
D.乙中正极上氧气得电子生成氢氧根离子,所以Fe电极上没有氢气生成,故D错误.
故选B.
点评 本题考查了金属的腐蚀与防护问题,注意根据原电池、电解原理分析,题目难度不大,侧重于考查基础知识的考查,注意把握电极方程式的书写方法.

练习册系列答案
 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
14.下列有关叙述正确的是( )
| A. | 稀硝酸和氢氧化亚铁反应的离子方程式:Fe(OH)2+2H+═Fe2++2H2O | |
| B. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| C. | 在酸性溶液中,Na+、K+、MnO4-、Br-能大量共存 | |
| D. | 除去Mg2+溶液中的少量Al3+,可以采用加入足量的氢氧化钠后过滤、再加酸的方法 |
1.用石墨作电极,电解1mol•L-1下列物质的溶液,则电解前后溶液的pH保持不变的是( )
| A. | H2SO4 | B. | NaOH | C. | Na2SO4 | D. | NaCl |
17.表示下列反应的离子方程式正确的是( )
| A. | 金属钠加入到CuSO4溶液中:2Na+Cu2+═Cu+2Na+ | |
| B. | 铁粉加入到FeCl3溶液中:Fe+2Fe3+═3Fe2+ | |
| C. | 金属铝加入到NaOH溶液中:Al+2OH-+H2O═AlO2-+2H2↑ | |
| D. | 铜片插入到AgNO3溶液中:Cu+Ag+═Cu2++Ag |
14.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2LH2O所含分子数为0.5NA | |
| B. | 1mol•L-1CaCl2溶液中所含Ca2+离子的数目为NA | |
| C. | 通常状况下,32gO2与32gO3所含的氧原子数均为2NA | |
| D. | 0.1molZn与含0.1molHCl的盐酸溶液充分反应,转移电子数目为0.2NA |
15.已知含Cr(Ⅵ)的盐溶液存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O,改变溶液中CrO42-、Cr2O72-的离子浓度比,可使溶液颜色发生变化.现向显黄色的试液中加入哪种物质,能使溶液变为橙色( )
| A. | H2O | B. | 硫酸 | C. | NaOH(s) | D. | Na2SO4(s) |
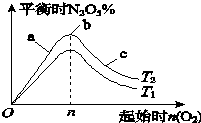 某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.
某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.