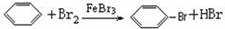题目内容
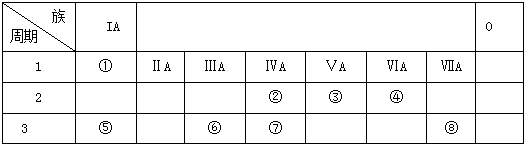
如表是周期表中的一部分,根据A-I在周期表中的位置,用元素符号或化学式回答下列问题:
①A E F H I
②H的离子结构示意图为 ,H元素在周期表中位置表示为: 周期 族.
③B、Mg、C三种元素的金属性由强到弱顺序为 ,
④D、E、G三种元素的原子半径从大到小顺序为 ,元素的非金属性由强到弱顺序为 .
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | Mg | C | F | H |
②H的离子结构示意图为
③B、Mg、C三种元素的金属性由强到弱顺序为
④D、E、G三种元素的原子半径从大到小顺序为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:①由元素在周期表中位置可知,A为氢、B为Na、C为Al、D为碳、E为氮、F为磷、G为氟、H为Cl、I为Ne;
②Cl-离子核电荷数为17,核外电子数为18,有3个电子层,各层电子数为2、8、8;由H在周期表中位置可知其位于第三周期ⅦA族;
③同周期自左而右金属性减弱;
④同周期自左而右原子半径减小,元素非金属性增强.
②Cl-离子核电荷数为17,核外电子数为18,有3个电子层,各层电子数为2、8、8;由H在周期表中位置可知其位于第三周期ⅦA族;
③同周期自左而右金属性减弱;
④同周期自左而右原子半径减小,元素非金属性增强.
解答:
解:①由元素在周期表中位置可知,A为氢、B为Na、C为Al、D为碳、E为氮、F为磷、G为氟、H为Cl、I为Ne,故答案为:H;N;P;Cl;Ne;
②Cl-离子核电荷数为17,核外电子数为18,有3个电子层,各层电子数为2、8、8,离子结构示意图为 ;由H在周期表中位置可知其位于第三周期ⅦA族,故答案为:
;由H在周期表中位置可知其位于第三周期ⅦA族,故答案为: ;三、ⅦA;
;三、ⅦA;
③同周期自左而右金属性减弱,故金属性:Na>Mg>Al,故答案为:Na>Mg>Al;
④同周期自左而右原子半径减小,元素非金属性增强,故原子半径:C>N>F,非金属性:F>N>C,故答案为:C>N>F;F>N>C.
②Cl-离子核电荷数为17,核外电子数为18,有3个电子层,各层电子数为2、8、8,离子结构示意图为
 ;由H在周期表中位置可知其位于第三周期ⅦA族,故答案为:
;由H在周期表中位置可知其位于第三周期ⅦA族,故答案为: ;三、ⅦA;
;三、ⅦA;③同周期自左而右金属性减弱,故金属性:Na>Mg>Al,故答案为:Na>Mg>Al;
④同周期自左而右原子半径减小,元素非金属性增强,故原子半径:C>N>F,非金属性:F>N>C,故答案为:C>N>F;F>N>C.
点评:本题考查元素周期表与元素周期律综合应用,难度不大,侧重对元素周期律的考查,注意对基础知识的掌握.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、标准标况下,22.4L水所含的分子数目为6.02×1023个 |
| B、2g氢气所含氢原子数目为2×6.02×1023个 |
| C、500ml2mol?L-1的Ba(NO3)2溶液中含NO3-离子数为2×6.02×1023个 |
| D、0.5mol氯气分子中含Cl原子数为6.02×1023个 |
加入镁粉后会产生氢气的溶液中能大量共存的无色透明离子组是( )
| A、K+、Na+、NO3-、MnO4- |
| B、K+、Na十、Br-、CO32- |
| C、Mg2+、Na+、Cl-、SO42- |
| D、Na十、Ba2+、OH-、SO42- |
 欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.