题目内容
6.新制氯水含有多种粒子,为检验其成分,某研究性学习小组做了如下实验,请根据所做实验,按要求填空.(1)取少量新制氯水于试管中,加入碳酸钙粉末,发现有气泡产生,则说明起作用的成分是HCl(化学式),该物质在溶液中表现出酸性;
(2)取少量新制氯水于试管中,加入AgNO3溶液,发现有白色沉淀产生,则起作用的是Cl-(离子);
(3)取少量新制氯水于试管中,加入一块红纸,发现很快褪色,则起作用的是HClO(化学式);
(4)取少量新制氯水于试管中,加入FeCl2溶液,发现很快变黄,起作用的成分是氯气(名称),反应离子方程式2Fe2++Cl2=2Fe3++2Cl-.
分析 氯气溶于水发生反应Cl2+H2O?HCl+HClO,新制氯水含有Cl2、H2O、HClO、H+、Cl-等粒子,其中H+可与碳酸钙等物质反应,而Cl2、HClO具有强氧化性,HClO具有漂白性,溶液中含有Cl-可与硝酸银反应生成白色AgCl沉淀,以此解答该题.
解答 解:(1)氯气溶于水发生反应Cl2+H2O?HCl+HClO,新制氯水含有Cl2、H2O、HClO、H+、Cl-等粒子,其中盐酸和碳酸钙反应生成氯化钙和二氧化碳气体,HCl表现出酸性,故答案为:HCl;酸;
(2)溶液中含有Cl-可与硝酸银反应生成白色AgCl沉淀,故答案为:Cl-;
(3)HClO具有漂白性,可使有色物质褪色,故答案为:HClO;
(4)加入FeCl2溶液,发现很快变黄,原因是生成FeCl3,说明氯气具有强氧化性将FeCl2溶液氧化成FeCl3,离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;故答案为:氯气;2Fe2++Cl2=2Fe3++2Cl-.
点评 本题综合考查氯气和氯水的性质,注意把握氯气和水反应的特点以及氯水的成分和性质,为高考高频考点,侧重于基础知识的综合运用,难度不大.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
8.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 含有NA个氦原子的氦气的物质的量为2摩尔 | |
| B. | 2摩尔水的摩尔质量是1摩尔水的摩尔质量的2倍 | |
| C. | 25℃,1.01×105Pa,64g的SO2中含有的原子数为3NA | |
| D. | l摩尔任何物质所含的分子数均为NA |
9.CMU是一种荧光指示剂,可通过下列反应制备:
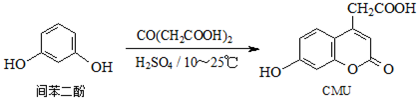
下列说法正确的是( )
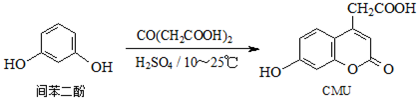
下列说法正确的是( )
| A. | 1molCMU最多可与1molBr2反应 | |
| B. | 1molCMU最多可与3molNaOH反应 | |
| C. | 可用FeCl3溶液鉴别间苯二酚和CMU | |
| D. | CMU在酸性条件下的水解产物只有1种 |
11.NA代表阿伏加德罗常数,下列叙述正确的是( )
| A. | 精炼铜过程中阴极增重6.4 g时,电路中转移电子数大于0.2NA | |
| B. | 标准状况下,11.2 L氨气溶于水配制成500 mL溶液,溶液中NH4+数目为0.5NA | |
| C. | 1 mol D318O+中含有的中子数为10NA | |
| D. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子总数等于0.1NA |
18.下列物质属于烃类的是( )
| A. | C2H5OH | B. | C3H8 | C. | CH3Br | D. | C6H5NO2 |
15.同温同压下,等质量的SO2与SO3相比较,下列叙述正确的( )
| A. | 分子个数比为4:5 | B. | 含硫元素质量比为4:5 | ||
| C. | 含氧原子个数比为5:6 | D. | 含硫原子个数比为5:6 |
16.现有浓度为0.02mol/L的HCN与0.01mol/LNaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是( )
| A. | c(H+)>c(OH-) | B. | c(H+)<c(OH-) | ||
| C. | c(H+)+c(HCN)=c(OH-) | D. | c(HCN)+c(CN-)=0.01mol/L |

 .
.