题目内容
11.NA代表阿伏加德罗常数,下列叙述正确的是( )| A. | 精炼铜过程中阴极增重6.4 g时,电路中转移电子数大于0.2NA | |
| B. | 标准状况下,11.2 L氨气溶于水配制成500 mL溶液,溶液中NH4+数目为0.5NA | |
| C. | 1 mol D318O+中含有的中子数为10NA | |
| D. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子总数等于0.1NA |
分析 A、精炼铜的过程中,阴极发生反应:Cu2++2e-=Cu;
B、氨气和水的反应为可逆反应;
C、D318O+中含13个中子;
D、Na2S和Na2O2的摩尔质量均为78g/mol.
解答 解:A、精炼铜的过程中,阴极发生反应:Cu2++2e-=Cu,故当阴极增重6.4g时,阴极得0.2mol电子,即电路中转移0.2NA个电子,故A错误;
B、氨气和水的反应为可逆反应,不能和水完全反应,且生成的一水合氨部分电离,故溶液中的铵根离子的个数小于0.5NA个,故B错误;
C、D318O+中含13个中子,故1molD318O+中含13NA个中子,故C错误;
D、Na2S和Na2O2的摩尔质量均为78g/mol,故7.8g混合物的物质的量为0.1mol,而硫化钠和过氧化钠均由2个钠离子和1个阴离子构成,故0.1mol混合物中含0.1NA个阴离子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
2.某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)?2C(g)达到平衡时,各物质的物质的量之比为n(A):n(B):n(C)=2:2:1.保持温度不变,以2:2:1的物质的量之比再充入A、B、C,则( )
| A. | 平衡正向移动 | |
| B. | 再达平衡时,n(A):n(B):n(C)仍为2:2:1 | |
| C. | 再达平衡时,C的体积分数减小 | |
| D. | 再达平衡时,正反应速率增大,逆反应速率减小 |
3.下列因素中不属于决定物质体积大小的因素是( )
| A. | 粒子的数目 | B. | 粒子的大小 | C. | 粒子之间的距离 | D. | 物质的类别 |
1.下列反应发生时,一定有电子转移的是( )
| A. | 化合反应 | B. | 有二氧化碳生成的反应 | ||
| C. | 铁生锈 | D. | 有水生成的反应 |

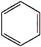 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr.
+HBr.