题目内容
17.下列实验操作正确且能达到目的是( )| A. | 将AlCl3溶液蒸发结晶提取无水AlCl3 | |
| B. | 在温水瓶中加入Na2CO3溶液浸泡后加入盐酸能除去内壁的CaSO4 | |
| C. | 用饱和的NaOH热溶液除去乙酸乙酯中的乙醇、乙酸 | |
| D. | 用酸性KMnO4溶液除去乙烷中混有的少量乙烯 |
分析 A.加热促进水解,水解生成盐酸易挥发;
B.加入Na2CO3溶液浸泡后,生成碳酸钙,碳酸钙能溶于盐酸;
C.乙酸、乙酸乙酯均与NaOH溶液反应;
D.乙烯被高锰酸钾氧化生成二氧化碳.
解答 解:A.加热促进水解,水解生成盐酸易挥发,则蒸发结晶不能制备,故A错误;
B.加入Na2CO3溶液浸泡后,生成碳酸钙,碳酸钙能溶于盐酸,可除去内壁的CaSO4,故B正确;
C.乙酸、乙酸乙酯均与NaOH溶液反应,不能除杂,应选饱和碳酸钠溶液、分液,故C错误;
D.乙烯被高锰酸钾氧化生成二氧化碳,引入新杂质,应选溴水、洗气,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握盐类水解、混合物分离提纯、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.利用下列装置不能完成对应实验的是( )
| A. |  实验室制取氨气 | B. | 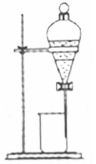 用CCl4萃取碘水中的碘 | ||
| C. | 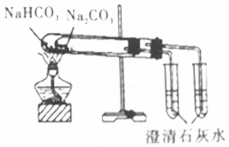 比较Na2CO3与NaHCO3的稳定性 | D. | 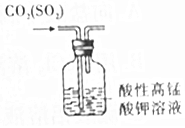 除去CO2中混有的少量SO2 |
8.下列物质中,既能溶于强酸溶液又能溶于强碱溶液的氧化物是( )
| A. | MgO | B. | Al2O3 | C. | SiO2 | D. | Al(OH)3 |
5. 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).如图表示该反应进行过程中能量的变化.关于该反应的下列说法中,正确的是( )
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).如图表示该反应进行过程中能量的变化.关于该反应的下列说法中,正确的是( )
 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).如图表示该反应进行过程中能量的变化.关于该反应的下列说法中,正确的是( )
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).如图表示该反应进行过程中能量的变化.关于该反应的下列说法中,正确的是( )| A. | △H>0,△S>0 | B. | △H>0,△S<0 | C. | △H<0,△S<0 | D. | △H<0,△S>0 |
2.下列反应的方程式正确的是( )
| A. | 蔗糖与浓硫酸混合产生刺激性气味的气体 C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O | |
| B. | 向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-═BaSO4↓ | |
| C. | Cu溶于稀硝酸HNO3:Cu+2H++NO3-═Cu2++NO2↑+H2O | |
| D. | 向溴化亚铁溶液中通入过量氯气:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |
9.已知向0.005mol/LFeCl3中加入0.01mol/LKSCN溶液,溶液呈红色.在这个反应体系中存在下述平衡
Fe3++3SCN-(无色)?Fe(SCN)3(红色)
下列叙述错误的是( )
Fe3++3SCN-(无色)?Fe(SCN)3(红色)
下列叙述错误的是( )
| A. | 向上述溶液中滴加几滴NaOH溶液,溶液颜色会加深,因为OH-与Fe3+生成了红褐色沉淀 | |
| B. | 向上述溶液中滴加几滴NaOH溶液,溶液颜色会变浅,因为OH-与Fe3+生成了红褐色沉淀,使Fe3+的浓度减小,平衡逆向移动,导致Fe(SCN)3的浓度减小 | |
| C. | 向上述溶液中滴加几滴1 mol/L KSCN溶液,溶液颜色会加深,因为SCN-的浓度增大,正反应速率加快,平衡正向移动,导致导致Fe(SCN)3的浓度增大 | |
| D. | 向上述溶液中分别滴加NaOH溶液和KSCN溶液过程中,Na+、K+的浓度大小对平衡体系没有影响 |
6.下列离子方程式书写正确的是( )
| A. | Fe溶于稀盐酸:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 稀盐酸与小苏打溶液混合:CO32-+2H+=CO2↑+H2O | |
| C. | 鸡蛋壳溶于食醋:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | AlCl3溶液中加入过量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
7.分类是化学研究的重要方法,下列物质分类错误的是( )
| A. | 化合物:干冰,明矾,烧碱 | B. | 同素异形体:C60,石墨,金刚石 | ||
| C. | 非电解质:乙醇,四氯化碳,氯气 | D. | 混合物:纯净矿泉水,盐酸,漂白粉 |