题目内容
2.某同学用如图所示的装置一实现用有机物燃烧氧化法来测定X的分子式.已知X的相对分子质量为62,且燃烧产物只有CO2和H2O.回答下列问题:
(1)圆底烧瓶a中所装试剂为MnO2,写出其中发生的化学反应方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;b仪器的名称是分液漏斗.
(2)取6.2gX进行实验,D装置增重5.4g,E装置增重8.8g,则X的分子式为C2H6O2.
分析 A中过氧化氢在二氧化锰催化作用下制备氧气,B用于干燥氧气,在C中样品被氧化生成水和二氧化碳,D用于吸收水,E用于吸收二氧化碳,取6.2gX进行实验,D装置增重5.4g,E装置增重8.8g,可知C、H的质量,进而计算O的质量,分别计算C、H、O的物质的量,结合相对分子质量可确定有机物分子式,以此解答该题.
解答 解:A中过氧化氢在二氧化锰催化作用下制备氧气,B用于干燥氧气,在C中样品被氧化生成水和二氧化碳,D用于吸收水,E用于吸收二氧化碳,
(1)b为分液漏斗,A为过氧化氢在二氧化锰催化作用下制备氧气,方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,故答案为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;分液漏斗;
(2)D装置增重5.4g,为水的质量,且n(H2O)=$\frac{5.4g}{18g/mol}$=0.3mol,n(H)=0.6mol,m(H)=0.6g,
E装置增重8.8g,为二氧化碳的质量,且n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol,n(C)=0.2mol,m(C)=0.2mol×12g/mol=2.4g,
则m(O)=6.2g-0.6g-2.4g=3.2g,n(O)=$\frac{3.2g}{16g/mol}$=0.2mol,
N(C):N(H):N(O)=0.2:0.6:.0.2=1:3:1,
设分子式为(CH3O)n,则有31n=62,n=2,
所以分子式为C2H6O2,
故答案为:C2H6O2.
点评 本题考查探究物质组成的实验,题目难度中等,明确实验原理为解答关键,试题侧重考查有机物分子式、结构简式的确定,注意掌握质量守恒定律在确定有机物分子式中的应用方法,试题培养了学生的分析、理解能力及化学实验能力.

| A. | 氧化性比较:S2O82 ->MnO4- | |
| B. | 氧化剂S2O82-的摩尔质量为 192 g/mol | |
| C. | 该反应中酸性介质可以为盐酸 | |
| D. | 若有0.1 mol氧化产物生成,则转移电子 0.5 mol |
| A. | 若要除去CO2中含有的少量SO2气体,可通过盛有饱和NaHCO3溶液的洗气瓶 | |
| B. | 在实验室中使用金属钠时若不慎着火,可立即用细沙灭火 | |
| C. | 用带有玻璃塞的玻璃瓶盛放NaOH溶液 | |
| D. | 测溶液pH时,可用干净的玻璃棒蘸取溶液滴到放在表面皿上的pH试纸上 |
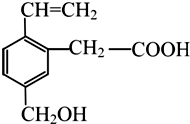 某有机物的结构如图所示,这种有机物具有的性质是( )
某有机物的结构如图所示,这种有机物具有的性质是( )①可以与氢气发生加成反应;
②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应;
④能发生酯化反应;
⑤能发生加聚反应.
| A. | 只有①④ | B. | 只有①④⑤ | C. | ①②③④ | D. | 全部 |
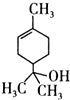 ,则下列说法错误的是( )
,则下列说法错误的是( )| A. | 1mol该物质最多能和lmol氢气发生加成反应 | |
| B. | 该物质属于烃 | |
| C. | 该物质能使溴水褪色 | |
| D. | 分子式为C10H18O |
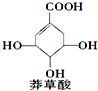 莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )| A. | 分子中含有2种官能团 | |
| B. | 在水溶液中羧基和羟基均能电离出H+ | |
| C. | 分子式为C7H6O5 | |
| D. | 可发生加成和取代反应 |
| A. | X的原子序数比Y的小 | B. | X原子的最外层电子数比Y的多 | ||
| C. | X的原子半径比Y的大 | D. | X元素的最高正价比Y的小 |
| A. | 分馏 | B. | 裂解 | C. | 催化裂化 | D. | 萃取 |
