题目内容
15.表是元素周期表的一部分,已知⑤为短周期元素,其单质为淡黄色固体,据表回答有关问题:| ① | ② | ||||||
| ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| ⑧ | ⑨ |
(2)在这些元素中,最活泼的非金属元素是F,最不活泼的元素是Ar(写元素符号 ).
(3)在这些元素的最高价氧化物对应水化物中,碱性最强的是KOH(写化学式),呈两性的氢氧化物是Al(OH)3(写化学式),写出两者之间反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O
(4)在⑥与⑨中,化学性质较活泼的是Cl(写元素符号 ),写出可以验证该结论的一个化学反应方式Cl2+2NaBr=Br2+2NaCl.
分析 ⑤为短周期元素,其单质为淡黄色固体,则⑤为S元素,由元素的相对位置可知:①为Li、②为F、③为Na、④为Mg、⑤为Al、⑥为Cl、⑦为Ar、⑧为K、⑨为Br.
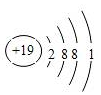
(1)⑧为K元素,原子核外有19个电子,各层电子数为2、8、8、1;
(2)F的非金属性最强,稀有气体的性质最稳定;
(3)金属性越强,对应碱的碱性越强;氢氧化铝能与强酸、强碱反应生成盐与水,属于两性氧化物;
(4)同主族从上到下,非金属性减弱,利用强制弱验证.
解答 解:⑥为短周期元素,其单质为淡黄色固体,则⑥为S元素,由元素的相对位置可知:①为Li、②为F、③为Na、④为Mg、⑤为Al、⑦为Cl、⑧为K、⑨为Br.
(1)⑧为K元素,原子核外有19个电子,各层电子数为2、8、8、1,原子结构示意图为: ,
,
故答案为: ;
;
(2)在这些元素中,F的非金属性最强,则最活泼的非金属是F,稀有气体的性质最稳定,则最不活泼的是Ar,
故答案为:F;Ar;
(3)金属性越强,对应碱的碱性越强,则这些元素的最高价氧化物对应水化物中,碱性最强的化合物的化学式是KOH;氢氧化铝能与强酸、强碱反应生成盐与水,属于两性氧化物;氢氧化铝与氢氧化钾反应生成偏铝酸钾、水,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:KOH;Al(OH)3;Al(OH)3+OH-=AlO2-+2H2O;
(4)同主族从上到下,非金属性减弱,则氯的非金属性强于溴,可以用氯气将溴从溴化钠的盐溶液中置换出来验证,反应的方程式为:Cl2+2NaBr=Br2+2NaCl,
故答案为:Cl;Cl2+2NaBr=Br2+2NaCl.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素周期律、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

| A. | 米酒变酸的过程涉及了氧化反应 | |
| B. | 汽油、柴油、植物油都是碳氢化合物 | |
| C. | 3.0 g 甲醛和乙酸的混合物中含有的原子总数为0.6NA | |
| D. | 0.1 mol C2H6O分子中含有C-H键数为0.5NA |
| A. | 0.15 mol/L的盐酸 | B. | 0.10mol/L的硫酸 | ||
| C. | 0.15 mol/L的醋酸 | D. | 0.10mol/L的氢硫酸 |

| A. | A 与金属钠完全反应时,两者物质的量之比为 1:3 | |
| B. | A 与氢氧化钠完全反应时,两者物质的量之比为 1:1 | |
| C. | A 能与碳酸钠溶液反应 | |
| D. | A 既能与羧酸反应,又能与醇反应 |
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | |
| B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| C. | Ba(OH)2•8H2O+2NH4Cl$\frac{\underline{\;研磨\;}}{\;}$BaCl2+2NH3↑+10H2O | |
| D. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体 | HX放出的氢气多且反应速率快 | HX酸性比HY强 |
| B | 向某溶液中滴入氯化钡溶液和稀硝酸 | 生成白色沉淀 | 说明原溶液含Ba2+ |
| C | 在稀硫酸中加入铜,再加入硝酸钠固体 | 开始无现象,后铜逐步溶解,溶液变蓝,有气泡产生 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
| D | 将一铝箔放在酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面生成致密的Al2O3薄膜,且Al2O3熔点高于Al |
| A. | A | B. | B | C. | C | D. | D |
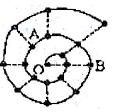 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | A、B组成的化合物中不可能含有共价键 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | B元素是图中金属性最强的元素 | |
| D. | 离O点越远的元素原子半径越大 |
| A. | 2-丙醇 | B. | 2-丁醇 | C. | 1-戊醇 | D. | 2-甲基-2-丙醇 |
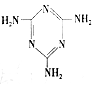 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸( 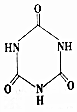 )
)