题目内容
6.下列各组溶液中H+ 浓度最大的是( )| A. | 0.15 mol/L的盐酸 | B. | 0.10mol/L的硫酸 | ||
| C. | 0.15 mol/L的醋酸 | D. | 0.10mol/L的氢硫酸 |
分析 首先判断电解质的强弱,如都为强电解质,则判断酸电离出氢离子的个数,以此解答该题.
解答 解:A.0.15 mol/L的盐酸中HCl是强电解质完全电离,溶液中氢离子浓度为0.15mol/L,
B.0.10mol/L的硫酸溶液中H2SO4为强电解质,溶液中氢离子浓度为0.20mol/L,
C.0.15 mol/L的醋酸溶液中醋酸为弱电解质,溶液中氢离子浓度小于0.15mol/L,
D.0.10mol/L的氢硫酸溶液中H2S为弱酸,溶液中氢离子浓度小于0.2mol/L,
上述分析可知溶液中H+ 浓度最大的是B,
故选B.
点评 本题考查电解质在溶液中的电离,题目难度不大,注意电解质的强弱判断和一元酸、二元酸的比较.

练习册系列答案
相关题目
16.已知短周期元素的离子aA2+、bB+、cC3-、dD- 都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径 A>B>D>C | B. | 原子序数 D>C>B>A | ||
| C. | 离子半径 C>D>B>A | D. | 单质的还原性 A>B>D>C |
17.在1L密闭容器中加入1molN2和3molH2,一定条件下发生反应:N2+3H2?2NH3,1min后测得生成0.06molNH3,该时间段内平均反应速率为( )
| A. | υ(NH3)=0.04mol•L-1•min-1 | B. | υ(H2)=0.06mol•L-1•min-1 | ||
| C. | υ(N2)=0.06mol•L-1•min-1 | D. | υ(N2)=0.03mol•L-1•min-1 |
14.只含有极性共价键的物质是( )
| A. | NH3 | B. | CaCl2 | C. | Cl2 | D. | K2S |
1.含氯消毒液(主要成分NaClO)与含氯洁厕灵(主要成分HCl)混用可能会造成中毒,其原因是:NaClO+2HCl═Cl2↑+NaCl+H2O.下列说法中正确的是( )
| A. | NaCl是还原产物 | |
| B. | NaClO只含有离子键 | |
| C. | 当释放(标况下)2.24L Cl2时,一定有6.02×1022个氯分子扩散到室内 | |
| D. | 使用消毒液时滴加食醋可加快作用发挥,其原因用离子方程式表示为 ClO-+CH3COOH═HClO+CH3COO- |
18.甲、乙、丙、丁四种有机物的结构简式及常见的反应类型如下:
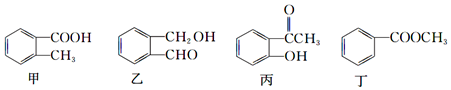
①加成反应
②取代反应
③氧化反应
④消去反应
⑤银镜反应
⑥与新制的Cu(OH)2反应
⑦酯化反应
下列对它们能发生的反应类型的判断中正确的是( )

①加成反应
②取代反应
③氧化反应
④消去反应
⑤银镜反应
⑥与新制的Cu(OH)2反应
⑦酯化反应
下列对它们能发生的反应类型的判断中正确的是( )
| A. | 甲:①②③④⑥⑦ | B. | 乙:①②③⑤⑥⑦ | C. | 丙:①②③④⑤⑥⑦ | D. | 丁:②③④⑤⑥⑦ |
15.表是元素周期表的一部分,已知⑤为短周期元素,其单质为淡黄色固体,据表回答有关问题:
(1)画出元素⑧的原子结构示意图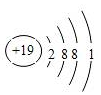
(2)在这些元素中,最活泼的非金属元素是F,最不活泼的元素是Ar(写元素符号 ).
(3)在这些元素的最高价氧化物对应水化物中,碱性最强的是KOH(写化学式),呈两性的氢氧化物是Al(OH)3(写化学式),写出两者之间反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O
(4)在⑥与⑨中,化学性质较活泼的是Cl(写元素符号 ),写出可以验证该结论的一个化学反应方式Cl2+2NaBr=Br2+2NaCl.
| ① | ② | ||||||
| ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| ⑧ | ⑨ |

(2)在这些元素中,最活泼的非金属元素是F,最不活泼的元素是Ar(写元素符号 ).
(3)在这些元素的最高价氧化物对应水化物中,碱性最强的是KOH(写化学式),呈两性的氢氧化物是Al(OH)3(写化学式),写出两者之间反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O
(4)在⑥与⑨中,化学性质较活泼的是Cl(写元素符号 ),写出可以验证该结论的一个化学反应方式Cl2+2NaBr=Br2+2NaCl.
9.一定量的稀硫酸和过量铁块反应时,为了加快反应速率,且不影响生成氢气的总量,下列措施不正确的是( )
| A. | 改用浓硫酸 | B. | 加热 | ||
| C. | 加入少量CuSO4固体 | D. | 将铁块改成铁粉 |