题目内容
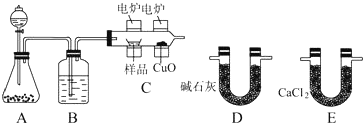
14.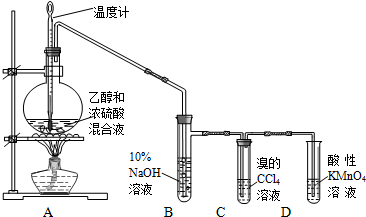 实验室制取乙烯并检验乙烯性质的装置如图.
实验室制取乙烯并检验乙烯性质的装置如图.请回答有关问题:
(1)烧瓶中除反应物以外,还应放2-3块碎瓷片,目的是防止暴沸.
(2)烧瓶中产生乙烯的反应方程式为
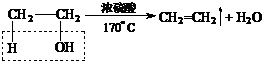 .
.(3)反应开始后,可观察到C和D中共同的现象是褪色;
C中的反应类型为加成反应、D中的反应类型为氧化反应.
(4)反应结束冷却至室温,处理烧瓶中废液发现,反应液变黑、且有强烈的刺激性气味气体,其原因是浓硫酸将乙醇炭化,浓硫酸被碳还原产生了SO2;10%的NaOH溶液起的作用是吸收挥发出的乙醇、乙酸和其它副产物气体(如乙醚、SO2和CO2等).
分析 (1)反应条件是加热到170℃,因乙醇的沸点低,易暴沸,所以放2-3块碎瓷片作沸石;
(2)实验室利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯;
(3)乙烯分子中含有碳碳双键,能和溴发生加成反应,乙烯使酸性高锰酸钾溶液褪色,是高锰酸钾和乙烯发生了氧化反应;
(4)混合液全呈黑色,浓硫酸具有强氧化性,能氧化乙醇,把乙醇氧化成碳,有强烈的刺激性气味气体是加热条件下浓硫酸被碳还原产生了SO2;10%的NaOH溶液起的作用是吸收挥发出的乙醇和其它副产物气体(如乙醚、SO2和CO2等)以防干扰检验乙烯性质实验.
解答 解:(1)反应条件是加热到170℃,因乙醇的沸点低,易暴沸,在圆底烧瓶中放2-3块碎瓷片的目的是防止暴沸,故答案为:防止暴沸;
(2)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生消去反应,所以实验室制取乙烯的化学方程式为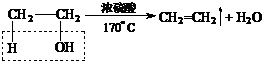 ,
,
故答案为: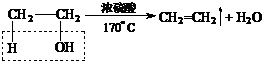 ;
;
(3)乙烯含有碳碳双键,能和溴发生加成反应Br2+CH2=CH2→BrCH2CH2Br生成1,2-二溴乙烷褪色,乙烯被酸性高锰酸钾溶液氧化5CH2=CH2+12KMnO4+18H2SO4→10CO2+12MnSO4+28H2O+6K2SO4,导致高锰酸钾溶液褪色,
故答案为:褪色;加成;氧化;
(4)反应结束冷却至室温,处理烧瓶中废液发现,反应液变黑是由于乙醇被浓硫酸氧化成碳,CH3CH2OH+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4SO2↑+CO2↑+7H2O+C;碳被浓硫酸氧化成二氧化碳,C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,且有强烈的刺激性气味气体为二氧化硫,因SO2+2NaOH=Na2SO3+H2O,CO2+2NaOH=Na2CO3+H2O,所以10%的NaOH溶液起的作用是吸收挥发出的乙醇其它副产物气体(如乙醚、SO2和CO2等)以防干扰检验乙烯性质实验,
故答案为:浓硫酸将乙醇炭化,浓硫酸被碳还原产生了SO2;吸收挥发出的乙醇和其它副产物气体(如乙醚、SO2和CO2等).
点评 本题考查了乙烯的实验室制法并检验乙烯性质,掌握反应的原理和乙烯的化学性质以及以及有关实验操作是解答本题的关键,题目较简单.

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案| A | 20℃ | 铁片 | 1mol/L硫酸 | B | 30℃ | 铁粉 | 1mol/L稀硫酸 |
| C | 30℃ | 铁粉 | 2mol/L稀硫酸 | D | 30℃ | 铁片 | 2mol/L稀硫酸 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 乙烯、乙醇、过氧化钠、CaCl2都含有非极性键 | |
| B. | 乙醇、乙酸、水分子中均含有氢键 | |
| C. | 甲苯分子中共平面的原子最多有13个 | |
| D. | BF3、PCl3、CCl4、苯中所有原子全部满足最外层为8个电子结构 |
①过滤②溶解③加入适量Ca(OH)2④蒸发结晶⑤用盐酸溶解⑥电解熔融MgCl2⑦MgCl2•6H2O脱水.
| A. | ⑤③①②④⑥⑦ | B. | ②③①⑤④⑦⑥ | C. | ②④①③⑦⑤⑥ | D. | ⑤③①④②⑦⑥ |
| A. | 1:2 | B. | 1:3 | C. | 2:1 | D. | 3:2 |
| A. | 0.01mol | B. | 0.005mol | C. | 0.0133mol | D. | 0.0mol |
 )是一种重要的化工原料,下面是以环戊烷为原料制备环戊二烯的合成路线:
)是一种重要的化工原料,下面是以环戊烷为原料制备环戊二烯的合成路线:
 ),途径如下:
),途径如下:
 和
和 .
.