题目内容
19.下列叙述正确的是( )| A. | NH3分子中含有非极性键 | B. | CCl4分子中含有离子键 | ||
| C. | H2O分子中只有极性键 | D. | CO2分子中没有极性键 |
分析 非极性共价键为同种非金属元素的原子间形成共价键;极性共价键是由不同种非金属元素的原子间易形成的共价键,离子键是阴阳离子键强烈的静电作用,存在于离子化合物中,据此进行判断.
解答 解:A、NH3中的N-H键均为极性键,分子中无非极性键,故A错误;
B、CCl4分子中是不同种非金属原子形成的极性键,没有离子键,故B错误;
C、H2O中只含有O-H极性键,故C正确;
D、CO2中有C、O元素之间形成极性键,无非极性键,故D错误;
故选C.
点评 本题考查化学键的极性、非极性,题目难度不大,明确判断方法是解答本题的关键,试题培养了学生灵活应用所学知识解决实际问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.用一种试剂就能将下列五种有机物区分开来,①乙酸;②乙醛;③苯;④苯酚;⑤四氯化碳;这种试剂可以是( )
| A. | . 酸性高锰酸钾溶液 | B. | 溴水 | ||
| C. | 新制的氢氧化铜悬浊液 | D. | 氯化铁溶液 |
14.下列说法中正确的是(NA表示阿伏加德罗常数的数值)( )
| A. | 71g氯气含有的原子数目为NA | |
| B. | 4 g金属钙变成钙离子时失去的电子数目为0.1NA | |
| C. | 标准状况下,22.4LH2O中含有的分子数为NA | |
| D. | 在标准状况下,22.4 L甲烷与乙炔的混合物所含分子数为NA |
4.下列有关物质与其用途不相对应的是( )
| A. | 氮化硅陶瓷--导热剂 | B. | Si和Ge--半导体材料 | ||
| C. | 钢化玻璃--汽车窗玻璃 | D. | SiO2--制光纤 |
11.某原电池总反应的离子方程式是:Zn+Cu2+═Zn2++Cu,依据此反应设计原电池的正确组合是( )
| 选项 | 正极 | 负极 | 电解质溶液 |
| A | Cu | Zn | 稀盐酸 |
| B | C | Zn | 硫酸铜溶液 |
| C | Cu | Zn | 氯化铜溶液 |
| D | Cu | Zn | 硝酸铜溶液 |
| A. | A | B. | B | C. | C | D. | D |
20.下列物质直接排放不会引起环境污染的是( )
| A. | 甲醛 | B. | 苯酚 | C. | 氮气 | D. | 二氧化硫 |
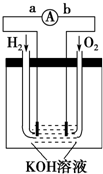 氢氧燃料电池是符合绿色化学理念的新型发电装置.
氢氧燃料电池是符合绿色化学理念的新型发电装置.