题目内容
8.某有机物M7.4g与足量氧气反应后,所得气体依次通过盛有浓H2SO4和碱石灰的装置,两装置分别增重9g和17.6g;同温同压下,M蒸汽的密度是H2的37倍,则能够与钠反应放出H2的M的同分异构体的数目(不考虑立体异构)( )| A. | 2 | B. | 4 | C. | 6 | D. | 8 |
分析 根据浓硫酸、碱石灰的装置的质量计算出有机物燃烧生成水、二氧化碳的物质的量,根据M蒸汽与氢气的相对密度计算出M的摩尔质量,然后计算出7.4gM的物质的量,根据质量守恒计算出7.4gM中含有氧元素的质量、物质的量,从而确定M的分子式,再根据有机物能够与钠反应确定其含有的官能团,最后确定其同分异构体数目.
解答 解:浓硫酸增重的为水的质量,则n(H2O)=$\frac{9g}{18g/mol}$=0.5 mol,
碱石灰增重的为二氧化碳的质量,则n(CO2)=$\frac{17.6g}{44g/mol}$=0.4 mol,
M蒸汽的密度是H2的37倍,则M的摩尔质量为:2g/mol×37=74g/mol,
7.4gM的物质的量为:n(M)=$\frac{7.4g}{74g/mol}$=0.1 mol,
7.4gM中含有氧元素的物质的量为:n(O)=$\frac{7.4g-0.5mol×2×1g/mol-12g/mol×0.4mol}{16g/mol}$=0.1 mol,
该有机物分子中含有C、H、O原子数目为:$\frac{0.4mol}{0.1mol}$=4、$\frac{0.5mol×2}{0.1mol}$=10、$\frac{0.1mol}{0.1mol}$=1,
则有机物的分子式为C4H10O,
能与Na反应生成H2的是醇,该有机物为丁醇,
丁基有4种同分异构体,所以丁醇也有4种同分异构体:CH3CH2CH2CH2OH、CH3CHOHCH2CH3、(CH3)3COH、(CH3)2CHOHCH3,
故选B.
点评 本题考查了有机物分子式、结构简式的计算、同分异构体的求算,题目难度中等,注意掌握确定有机物分子式、结构简式的方法,明确同分异构体数目的求算方法.

练习册系列答案
相关题目
19.下列叙述正确的是( )
| A. | NH3分子中含有非极性键 | B. | CCl4分子中含有离子键 | ||
| C. | H2O分子中只有极性键 | D. | CO2分子中没有极性键 |
3.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
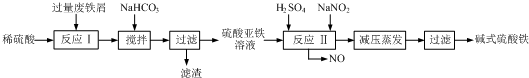
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH,使溶液中的Al3+沉淀,该工艺中“搅拌”的作用是加快反应速率.
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作氧化剂.若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH,使溶液中的Al3+沉淀,该工艺中“搅拌”的作用是加快反应速率.
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作氧化剂.若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.
11.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,2.24L氯气与水反应,转移的电子数为0.2NA | |
| B. | 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA | |
| C. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| D. | 标准状况下,11.2L三氧化硫所含分子数为0.5NA |
 不锈钢是一种常见的合金,耐高温,加工性能好,在生产生活中有广泛用途.一种不锈钢的主要成分是Fe、Ni、Cr、Si、P.回答下列问题:
不锈钢是一种常见的合金,耐高温,加工性能好,在生产生活中有广泛用途.一种不锈钢的主要成分是Fe、Ni、Cr、Si、P.回答下列问题: .
.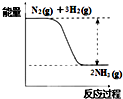 在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系.
在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系.
 .
.