题目内容
14.下列说法中正确的是(NA表示阿伏加德罗常数的数值)( )| A. | 71g氯气含有的原子数目为NA | |
| B. | 4 g金属钙变成钙离子时失去的电子数目为0.1NA | |
| C. | 标准状况下,22.4LH2O中含有的分子数为NA | |
| D. | 在标准状况下,22.4 L甲烷与乙炔的混合物所含分子数为NA |
分析 A.1个氯气分子含有2个氯原子;
B.先计算4g金属钙变成钙离子失去的电子数,再计算4g金属钙变成钙离子时失去的电子数;
C.气体摩尔体积使用对象为气体;
D.根据n=$\frac{V}{Vm}$计算混合气体的物质的量,依据N=NA•n判断.
解答 解;A.71g氯气物质的量为$\frac{71g}{71g/mol}$=1mol,含有的原子数目为2NA,故A错误;
B.40g金属钙变成钙离子时失去的电子数目为2NA,所以4g金属钙变成钙离子时失去的电子数目为0.2NA,故B错误;
C.标况下,水是液体,不能使用气体摩尔体积,故C错误;
D.在标准状况下,22.4 L甲烷与乙炔的混合物物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,所含分子数为NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数,题目难度不大,本题注意把握物质的组成元素的原子结构特点,把握物质的量的相关计算公式的运用是解题关键,注意气体摩尔体积使用条件和对象.

练习册系列答案
相关题目
4.加热试管中的NH4HCO3,使放出的气体依次通过盛有足量过氧化钠的干燥管、足量浓硫酸的洗气瓶,最后得到的气体是( )
| A. | NH3 | B. | O2 | C. | H2O | D. | CO2 |
5. 一定温度下,将1mol A和1mol B 气体充入2L恒容密闭容器中,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确的是( )
一定温度下,将1mol A和1mol B 气体充入2L恒容密闭容器中,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确的是( )
 一定温度下,将1mol A和1mol B 气体充入2L恒容密闭容器中,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确的是( )
一定温度下,将1mol A和1mol B 气体充入2L恒容密闭容器中,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示.下列说法正确的是( )| A. | 反应方程式中的x=1 | |
| B. | t3时刻改变的条件是移去少量物质D | |
| C. | t2时刻改变的条件是使用催化剂 | |
| D. | t1~t3间该反应的平衡常数均为4 |
2.下列反应属于取代反应的是( )
| A. | 甲烷的燃烧 | B. | 由甲烷制取氯仿 | C. | 甲烷遇明火爆炸 | D. | 由甲烷制取炭黑 |
9.2008年奥运会在北京举行时用大型遥控飞艇作为宣传工具以渲染活动气氛,为了使飞艇在空中安全而有效,你认为飞艇内充入哪种气体最好( )
| A. | 氢气 | B. | 氦气 | C. | 氧气 | D. | 二氧化碳 |
19.下列叙述正确的是( )
| A. | NH3分子中含有非极性键 | B. | CCl4分子中含有离子键 | ||
| C. | H2O分子中只有极性键 | D. | CO2分子中没有极性键 |
6.在溶液中发生的反应,对反应速率不产生影响的因素是( )
| A. | 温度 | B. | 压强 | C. | 浓度 | D. | 催化剂 |
3.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
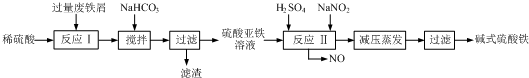
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH,使溶液中的Al3+沉淀,该工艺中“搅拌”的作用是加快反应速率.
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作氧化剂.若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH,使溶液中的Al3+沉淀,该工艺中“搅拌”的作用是加快反应速率.
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作氧化剂.若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D.
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.
15.“氢能”将是未来最理想的新能源.工业上常用H2与N2合成氨气,其热化学反应方程式如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol-1,在某密闭容器中,将1mol的氮气与过量的氢气充分混合反应后,放出的热量为( )
| A. | 一定小于92.4kJ | B. | 一定等于92.4kJ | C. | 可能大于92.4kJ | D. | 都有可能 |