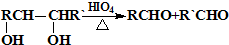题目内容
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,11.2 L氧气所含的原子数为 NA |
| B、1.8 g 的NH4+离子中含有的电子数为 10NA |
| C、常温常压下,48 g O3含有的氧原子数为 3NA |
| D、2.4 g金属镁变为镁离子时失去的电子数为 0.1NA |
考点:电离方程式的书写
专题:
分析:A.常温常压下,不是标准状况下,不能使用标况下的气体摩尔体积计算氧气的物质的量;
B.铵根离子含有10个电子,1.8g铵根离子的物质的量0.1mol,含有1mol电子;
C.48g臭氧分子中含有48g氧原子,含有3mol氧原子;
D.镁为2价金属,2.4g镁的物质的量为0.1mol,完全反应变成镁离子失去0.2mol电子.
B.铵根离子含有10个电子,1.8g铵根离子的物质的量0.1mol,含有1mol电子;
C.48g臭氧分子中含有48g氧原子,含有3mol氧原子;
D.镁为2价金属,2.4g镁的物质的量为0.1mol,完全反应变成镁离子失去0.2mol电子.
解答:
解:A.不是标况下,不能使用标况下的气体摩尔体积计算11.2L氧气的物质的量,故A错误;
B.1.8g铵根离子的物质的量为:
=0.1mol,0.1mol铵根离子中含有1mol电子,含有的电子数为NA,故B错误;
C.48g臭氧中含有48g氧原子,含有氧原子的物质的量为:
=3mol,含有氧原子数为3NA,故C正确;
D.2.4g镁的物质的量为:
=0.1mol,0.1mol镁变成镁离子失去0.2mol电子,失去的电子数为 0.2NA,故D错误;
故选C.
B.1.8g铵根离子的物质的量为:
| 1.8g |
| 18g/mol |
C.48g臭氧中含有48g氧原子,含有氧原子的物质的量为:
| 48g |
| 16g/mol |
D.2.4g镁的物质的量为:
| 2.4g |
| 24g/mol |
故选C.
点评:本题考查了有关物质的量的计算,题目难度中等,明确物质的量与阿伏伽德罗常数、摩尔质量、标况下气体摩尔体积等物理量之间的关系为解答关键,试题有利于培养学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在3S+6KOH=2K2S+K2SO3+3H2O这个反应中,被氧化与被还原的S原子个数比( )
| A、1:2 | B、2:1 |
| C、1:1 | D、3:1 |
下列说法正确的是( )
| A、同周期相邻主族的两元素原子序数均相差1 |
| B、原子最外层有2个电子的元素一定是金属元素 |
| C、第ⅦA族元素从上到下,其氢化物的酸性逐渐增强 |
| D、同主族元素从上到下,单质的熔点逐渐降低 |
阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是( )
| A、1molN2所含分子数约为6.02×1023 |
| B、58.5g NaCl所含离子数约为6.02×1023 |
| C、标准状况下,22.4L H2所含原子数约为6.02×1023 |
| D、常温常压下,分子总数约为6.02×1023的SO2的质量是64 |
将30mL0.5mol/LNaCl溶液加水稀释到300mL,稀释后溶液中NaCl的物质量浓度为( )
| A、0.03mol/L |
| B、0.3mol/L |
| C、0.05mol/L |
| D、0.04mol/L |

 A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.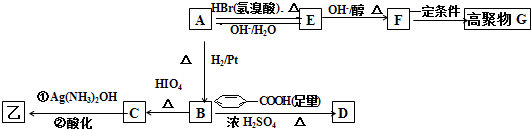
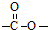 结构的基团,B在HIO4存在并加热时只生成一种产物C,下列为各相关反应的信息和转化关系:
结构的基团,B在HIO4存在并加热时只生成一种产物C,下列为各相关反应的信息和转化关系: