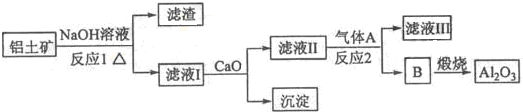
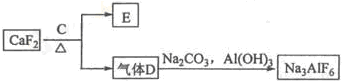
题目内容
将30mL0.5mol/LNaCl溶液加水稀释到300mL,稀释后溶液中NaCl的物质量浓度为( )
| A、0.03mol/L |
| B、0.3mol/L |
| C、0.05mol/L |
| D、0.04mol/L |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:根据稀释定律,稀释前后溶质NaCl的物质的量不变,据此计算稀释后NaCl溶液的物质的量浓度.
解答:
解:令稀释后NaCl溶液的物质的量浓度为c,根据稀释定律,稀释前后溶质NaCl的物质的量不变,则:
30mL×0.5mol/L=300mL×c,解得c=0.05mol/L,
故选C.
30mL×0.5mol/L=300mL×c,解得c=0.05mol/L,
故选C.
点评:本题考查了物质的量浓度的有关计算,侧重于稀释定律的应用的考查,题目难度不大.

练习册系列答案
相关题目
一定条件下,反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在5L密闭容器中进行,10s后H2O的物质的量增加了0.60mol,则10s内反应的速率v(X)可表示为( )
| A、v (NH3)=0.008 mol/(L?s) |
| B、v (NO)=0.04 mol/(L?s) |
| C、v (O2)=0.006 mol/(L?s) |
| D、v (H2O)=0.06 mol/(L.min) |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、1molCl2参加的任何反应转移电子数都是2NA |
| B、1mol/L的NaCl溶液中含有NA个Na+ |
| C、标准状况下,22.4ml水中含有的分子数约为1.24NA |
| D、1molFeCl3完全水解生成NA个胶体粒子 |
NA为阿伏加德罗常数,下列物质所含分子数最少的是( )
| A、含NA个分子的二氧化硫 |
| B、0.5 mol氧气 |
| C、标准状况下5.6 L氢气 |
| D、9 g水 |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,11.2 L氧气所含的原子数为 NA |
| B、1.8 g 的NH4+离子中含有的电子数为 10NA |
| C、常温常压下,48 g O3含有的氧原子数为 3NA |
| D、2.4 g金属镁变为镁离子时失去的电子数为 0.1NA |
溶液、胶体、浊液这三种分散系的本质区别是( )
| A、分散质粒子大小不同 |
| B、稳定性不同 |
| C、是否具有丁达尔效应 |
| D、能否透过滤纸 |