题目内容
以下一些单质和氧化物之间可发生如图所示的反应:其中,氧化物(Ⅰ)是红棕色固体,氧化物(Ⅱ),(Ⅲ),(Ⅳ)在反应条件下都是气体.

(1)氧化物(Ⅰ)的化学式是 ;氧化物(Ⅱ)的化学式是 ;
(2)反应①的化学方程式是 ;反应②的化学方程式是 ;反应③的化学方程式是 .

(1)氧化物(Ⅰ)的化学式是
(2)反应①的化学方程式是
考点:酸、碱、盐、氧化物的概念及其相互联系
专题:物质的分类专题
分析:根据氧化物(Ⅰ)是红棕色固体,故氧化物(Ⅰ)是Fe2O3;由于氧化物(Ⅱ)是气体,故为CO,则单质(I)是Fe,氧化物(IV)是CO2;氧化物(Ⅲ)在高温条件下为气体,则为H2O,故单质(II)为H2;由于氧化物(III)即CO和单质(III)在高温条件下生成H2和CO,故单质(III)为C,据此解答.
解答:
解:根据氧化物(Ⅰ)是红棕色固体,故氧化物(Ⅰ)是Fe2O3;由于氧化物(Ⅱ)是气体,故为CO,则单质(I)是Fe,氧化物(IV)是CO2;氧化物(Ⅲ)在高温条件下为气体,则为H2O,故单质(II)为H2;由于氧化物(III)即CO和单质(III)在高温条件下生成H2和CO,故单质(III)为C.
(1)氧化物(Ⅰ)的化学式是Fe2O3;氧化物(Ⅱ)的化学式是CO,故答案为:Fe2O3,CO;
(2)反应①是Fe2O3与CO在高温条件下发生氧化还原反应生成Fe和CO2,故化学方程式为:Fe2O3+3CO
2Fe+3CO2;反应②是CO和H2O在高温条件下生成CO2和H2,故化学方程式为:CO+H2O
CO2+H2;反应③是H2O和C在高温条件下生成H2和CO,故化学方程式为:H2O+C
H2+CO,
故答案为:Fe2O3+3CO
2Fe+3CO2;CO+H2O
CO2+H2;H2O+C
H2+CO.
(1)氧化物(Ⅰ)的化学式是Fe2O3;氧化物(Ⅱ)的化学式是CO,故答案为:Fe2O3,CO;
(2)反应①是Fe2O3与CO在高温条件下发生氧化还原反应生成Fe和CO2,故化学方程式为:Fe2O3+3CO
| ||
| ||
| ||
故答案为:Fe2O3+3CO
| ||
| ||
| ||
点评:本题考查了无机物的框图推断题,氧化物(Ⅰ)是红棕色固体是本题的突破口,难度不大,熟练掌握常见的化学方程式是解题关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
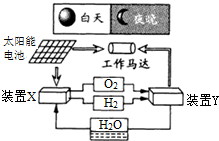

| A、该系统中只存在3种形式的能量转化 |
| B、装置Y中电能转化为化学能 |
| C、装置X能实现燃料电池的燃料和氧化剂再生 |
| D、装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、1molCl2参加的任何反应转移电子数都是2NA |
| B、1mol/L的NaCl溶液中含有NA个Na+ |
| C、标准状况下,22.4ml水中含有的分子数约为1.24NA |
| D、1molFeCl3完全水解生成NA个胶体粒子 |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,11.2 L氧气所含的原子数为 NA |
| B、1.8 g 的NH4+离子中含有的电子数为 10NA |
| C、常温常压下,48 g O3含有的氧原子数为 3NA |
| D、2.4 g金属镁变为镁离子时失去的电子数为 0.1NA |
溶液、胶体、浊液这三种分散系的本质区别是( )
| A、分散质粒子大小不同 |
| B、稳定性不同 |
| C、是否具有丁达尔效应 |
| D、能否透过滤纸 |
下列反应中,属于非氧化还原反应的是( )
| A、3CuS+8HNO3═3Cu(NO3)2+2NO↑+3S↓+4H2O |
| B、3Cl2+6KOH═5KCl+KClO3+3H2O |
| C、Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O |
| D、CuCl2+Ba(OH)2═Cu(OH)3↓+BaCl2 |