题目内容
下列说法正确的是( )
| A、同周期相邻主族的两元素原子序数均相差1 |
| B、原子最外层有2个电子的元素一定是金属元素 |
| C、第ⅦA族元素从上到下,其氢化物的酸性逐渐增强 |
| D、同主族元素从上到下,单质的熔点逐渐降低 |
考点:元素周期表的结构及其应用
专题:
分析:A、同一周期的ⅡA族和ⅢA族元素的原子序数可能相差1、11、25等;
B、氦最外层有2个电子;
C、同主族自上而下,非金属性减弱,氢化物稳定性减弱;
D、根据卤族元素自上而下单质熔沸点升高,碱金属自上而下单质熔沸点降低.
B、氦最外层有2个电子;
C、同主族自上而下,非金属性减弱,氢化物稳定性减弱;
D、根据卤族元素自上而下单质熔沸点升高,碱金属自上而下单质熔沸点降低.
解答:
解:A、同一周期的ⅡA族和ⅢA族元素的原子序数可能相差1、11、25等,故A错误;
B、氦最外层有2个电子,是稀有气体,故B错误;
C、同主族自上而下,非金属性减弱,氢化物稳定性减弱,酸性逐渐增强,故C正确;
D、根据卤族元素自上而下单质熔沸点升高,碱金属自上而下单质熔沸点降低,故D错误;
故选C.
B、氦最外层有2个电子,是稀有气体,故B错误;
C、同主族自上而下,非金属性减弱,氢化物稳定性减弱,酸性逐渐增强,故C正确;
D、根据卤族元素自上而下单质熔沸点升高,碱金属自上而下单质熔沸点降低,故D错误;
故选C.
点评:本题考查同周期元素性质递变规律和差异性,比较基础,注意从原子结构理解金属性、非金属性递变规律.

练习册系列答案
相关题目
常温下,有下列四种溶液:下列说法正确的是( )
| ① | ② | ③ | ④ |
| 0.1mol/L NaOH溶液 | pH=11 NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH=3 CH3COOH溶液 |
| A、由水电离出的c(H+):③<① |
| B、③稀释到原来的100倍后,pH与④相同 |
| C、①与③混合,若溶液pH=7,则V(NaOH)>V(CH3COOH) |
| D、②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为:c(CH3COOˉ)>c(H+)>c(Na+)>c(OHˉ) |
如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
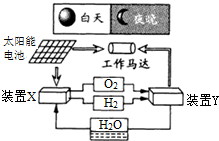

| A、该系统中只存在3种形式的能量转化 |
| B、装置Y中电能转化为化学能 |
| C、装置X能实现燃料电池的燃料和氧化剂再生 |
| D、装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
等物质的量浓度的KCl、MgCl2、AlCl3三种溶液.现欲完全沉淀其中的Cl-,消耗相同物质的量浓度的AgNO3溶液的体积比为3:2:1,则上述三种溶液的体积比为( )
| A、1:1:1 |
| B、6:3:2 |
| C、3:2:1 |
| D、9:3:1 |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、1molCl2参加的任何反应转移电子数都是2NA |
| B、1mol/L的NaCl溶液中含有NA个Na+ |
| C、标准状况下,22.4ml水中含有的分子数约为1.24NA |
| D、1molFeCl3完全水解生成NA个胶体粒子 |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,11.2 L氧气所含的原子数为 NA |
| B、1.8 g 的NH4+离子中含有的电子数为 10NA |
| C、常温常压下,48 g O3含有的氧原子数为 3NA |
| D、2.4 g金属镁变为镁离子时失去的电子数为 0.1NA |
下列反应中,属于非氧化还原反应的是( )
| A、3CuS+8HNO3═3Cu(NO3)2+2NO↑+3S↓+4H2O |
| B、3Cl2+6KOH═5KCl+KClO3+3H2O |
| C、Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O |
| D、CuCl2+Ba(OH)2═Cu(OH)3↓+BaCl2 |