题目内容
4.下列物质中,含有离子键的是( )| A. | H2 | B. | HCl | C. | NaCl | D. | CO2 |
分析 一般来说,非金属元素之间形成共价键,活泼金属元素与非金属元素之间形成离子键,以此来解答.
解答 解:A.H2中只有H-H共价键,故A不选;
B.HCl中只有H-Cl共价键,故B不选;
C.NaCl中钠离子与氯离子以离子键结合,故C选;
D.CO2中只有C、O之间的共价键,故D不选;
故选C.
点评 本题考查化学键,为高频考点,把握元素的类别及化学键形成的一般规律即可解答,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.

练习册系列答案
相关题目
1.pH相同的两份溶液(甲:盐酸,乙:醋酸)分别于锌粒反应,若最后锌都完全溶解,且放出气体一样多,那么下列判断不正确的是( )
| A. | 反应开始时速率:甲=乙 | B. | 反应所需时间:乙>甲 | ||
| C. | 参加反应时锌的质量:甲=乙 | D. | 两份酸溶液物质的量浓度:乙>甲 |
2.对三联苯是一种有机合成的中间体.工业上合成对三联苯的化学方程式为

下列说法中不正确的是( )

下列说法中不正确的是( )
| A. | 上述反应属于取代反应 | |
| B. | 对三联苯的一氯取代物有3种 | |
| C. | 1 mol对三联苯在足量的氧气中完全燃烧消耗21.5 mol O2 | |
| D. | 对三联苯分子中至少有16个原子共平面 |
6.关于铝原子或铝离子的结构错误的是( )
| A. | 原子的最外层电子数等于电子层数 | |
| B. | 反应中可失去三个电子,比镁、钠还原性弱 | |
| C. | 失去电子的铝离子半径比铝原子小 | |
| D. | 铝离子比镁离子、钠离子的半径大 |
13.下列离子方程式中,书写不正确的是( )
| A. | 常温下,Cl2与NaOH溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 稀H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H+十SO42-═BaSO4↓+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
14.设NA为阿伏加德罗常数值.下列有关叙述错误的是( )
| A. | 14 g乙烯和丙烯混合气体中的氢原子数为NA | |
| B. | 1 mol N2与4 mol H2反应生成的NH3分子数小于2NA | |
| C. | 1 mol Fe溶于过量硝酸,电子转移数为3NA | |
| D. | 标准状况下,2.24 L CH4含有的共价键数为0.4NA |

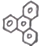 的一氯取代物有6种.
的一氯取代物有6种.