题目内容
16.下列实验操作、现象、结论或解释均正确的是( )| 选项 | 实验操作 | 现象 | 结论或解释 |
| A | 将某钾盐固体溶于盐酸 | 产生无色无味的气体 | 该钾盐是K2CO3 |
| B | 向可能含有Fe2+的Fe2(SO4)3溶液中加入酸性KMnO4溶液 | KMnO4溶液褪色 | 该溶液中一定含有Fe2+ |
| C | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| D | 向浓度均为0.1 mol•L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.能和稀盐酸反应生成无色无味气体的钾盐有K2CO3或KHCO3;
B.Fe2+能被酸性高锰酸钾溶液氧化生成Fe3+而使酸性高锰酸钾溶液褪色,Fe3+和酸性高锰酸钾溶液不反应;
C.NH4+和稀的NaOH溶液反应生成一水合氨而不是NH3;
D.溶度积常数小的物质先产生沉淀.
解答 解:A.能和稀盐酸反应生成无色无味气体的钾盐有K2CO3或KHCO3,所以该实验中钾盐不一定是碳酸钾,故A错误;
B.Fe2+能被酸性高锰酸钾溶液氧化生成Fe3+而使酸性高锰酸钾溶液褪色,Fe3+和酸性高锰酸钾溶液不反应,该实验中酸性高锰酸钾溶液褪色,说明含有Fe2+,故B正确;
C.NH4+和稀的NaOH溶液反应生成一水合氨而不是NH3,所以湿润的红色石蕊试纸不变蓝色,故C错误;
D.溶度积常数小的物质先产生沉淀,因为硝酸银不足量,产生黄色沉淀,说明溶度积Ksp(AgCl)>Ksp(AgI),故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及溶度积大小比较、离子检验、物质检验等知识点,明确实验原理及物质性质是解本题关键,注意从实验操作和评价性分析解答,易错选项是C.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验Ⅰ:将Fe3+转化为Fe2+(如图)
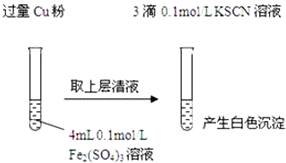
(1)Fe3+与Cu粉发生反应的离子方程式为2Fe3++Cu═2Fe2++Cu2+.
(2)探究白色沉淀产生的原因,请填写实验方案:查阅资料:
ⅰ.SCN-的化学性质与I-相似,ⅱ.2Cu2++4I-=2CuI↓(白色)+I2
Cu2+与SCN-反应的离子方程式为2Cu2++4SCN-=2Cu(SCN)↓+(SCN)2.
实验Ⅱ:将Fe2+转化为Fe3+
探究上述现象出现的原因:查阅资料:Fe2++NO?Fe(NO)2+(棕色)
(3)用离子方程式解释NO 产生的原因3Fe2++4H++NO3-═3Fe3++NO↑+2H2O.
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ慢(填“快”或“慢”).
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是取反应后的黄色溶液于试管中,向其中加入几滴K3[Fe(CN)6]溶液或者KMnO4,溶液无明显变化,说明反应I是不可逆反应.
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因Fe2+被硝酸氧化为Fe3+,导致溶液中Fe2+浓度降低,导致平衡Fe2++NO?Fe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色.
实验Ⅰ:将Fe3+转化为Fe2+(如图)

(1)Fe3+与Cu粉发生反应的离子方程式为2Fe3++Cu═2Fe2++Cu2+.
(2)探究白色沉淀产生的原因,请填写实验方案:查阅资料:
ⅰ.SCN-的化学性质与I-相似,ⅱ.2Cu2++4I-=2CuI↓(白色)+I2
| 实验方案 | 现象 | 结论 |
| 步骤1:取4mL0.1mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
| 步骤2:取取4mL0.1mol/LFeSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 | 无明显现象 |
实验Ⅱ:将Fe2+转化为Fe3+
| 实验方案 | 现象 |
| 向3mL 0.1mol/L FeSO4溶液中加入1mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
(3)用离子方程式解释NO 产生的原因3Fe2++4H++NO3-═3Fe3++NO↑+2H2O.
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ慢(填“快”或“慢”).
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是取反应后的黄色溶液于试管中,向其中加入几滴K3[Fe(CN)6]溶液或者KMnO4,溶液无明显变化,说明反应I是不可逆反应.
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因Fe2+被硝酸氧化为Fe3+,导致溶液中Fe2+浓度降低,导致平衡Fe2++NO?Fe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由棕色变为黄色.
4.下列实验所对应的离子方程式正确的是( )
| A. | 向漂白粉溶液中通入SO2:Ca2++ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 向Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| C. | 在碳酸氢钡溶液中加入过量的氢氧化钠溶液:Ba2++2HCO3-+2OH-═BaCO3↓+CO32-+2H2O | |
| D. | 向Na2S2O3溶液中加入稀硫酸:S2O32-+4H+═SO42-+3S↓+2H2O |
11.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温下1L 0.1 mol•L-1的FeSO4溶液中含有0.4NA个氧原子 | |
| B. | 用碱性锌锰干电池作电源电解饱和食盐水,当消耗MnO2 8.7g时,可制得标况下氯气2.24L | |
| C. | 1.2g CaCO3与Mg3N2的混合物中含有质子数为0.6NA | |
| D. | 常温下,pH=7的0.5 mol﹒L-1的CH3COONH4溶液中,NH4+浓度为0.5 mol•L-1 |
1.为了除去氯化钾中含有的少量硫酸镁和氯化钙杂质,需进行下列六项操作:①加水溶解 ②加热蒸发得到晶体 ③加入过量的氢氧化钡溶液 ④加入适量的盐酸 ⑤加入过量碳酸钾 ⑥过滤,先后次序正确的是( )
| A. | ①④③⑤⑥② | B. | ①⑤③④⑥② | C. | ①③④⑥⑤② | D. | ①③⑤⑥④② |
8.下列选项中,离子方程式书写正确的是( )
| A. | 加入NaClO将污水中的NH3氧化成N2:3ClO-+2NH3=N2↑+3Cl-+3H2O | |
| B. | 泡沫灭火器的灭火原理:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ | |
| C. | “84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:ClO3-+5Cl-+6H+=3Cl2↑+3H2O | |
| D. | 用足量的氨水吸收硫酸工业尾气中的SO2:SO2+NH3•H2O=NH4++HSO3- |
5.下列有关实验设计、观察或记录、结论或解释都正确的是( )
| 选项 | 实验设计 | 观察或记录 | 结论或解释 |
| A | 将浓硝酸分多次加入Cu和稀硫酸的混合液中 | 产生红棕色气体 | 浓硝酸的还原产物是NO2 |
| B | 测某铵盐溶液的pH | pH>7 | NH4+水解生成NH3•H2O,使溶液显碱性 |
| C | 用湿润的淀粉碘化钾试纸检验某气体 | 试纸变蓝 | 该气体一定是Cl2 |
| D | 将20mL pH均为1的盐酸和醋酸分别加水稀释至pH为3 | 醋酸的体积变化大 | 醋酸是弱酸 |
| A. | A | B. | B | C. | C | D. | D |

 实验室制备硝基苯的主要步骤如下:
实验室制备硝基苯的主要步骤如下: