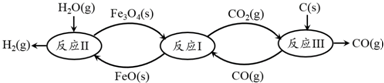
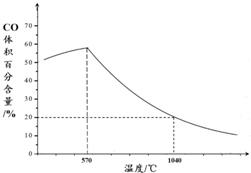
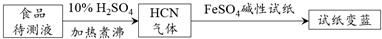
题目内容
7.工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素.霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾.(1)大气中的SO2在烟尘的催化下形成硫酸的反应方程式是2SO2+2H2O+O2$\frac{\underline{\;烟尘\;}}{\;}$2H2SO4.
(2)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1.
(3)烟气中的SO2可以用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示.(电极材料为石墨)

①图中a极要连接电源的负(填“正”或“负”)极,C口流出的物质是硫酸.
②SO32-放电的电极反应式为SO32-+H2O=SO42-+2H+.
③电解过程中若消耗12.6g Na2SO3,则阴极区变化的质量为4.4g(假设该过程中所有液体进出口密闭).
(4)常温下,烟气中的SO2被NaOH溶液吸收可得到NaHSO3、Na2SO3等.
①已知Na2SO3水溶液显碱性,原因是SO32-+H2O?HSO3-+OH-(写出主要反应的离子方程式),该溶液中,c(Na+)<2c(S032-)+c(HSO3-)+c(OH-)(填“>”“<”或“=”).
②常温下,0.1mol•L-1的NaHSO3溶液的pH=6,则c(SO32-)-c(H2SO3)=9.9×10-7(填写准确数值)mol•L-1.
分析 (1)大气中的SO2在烟尘的催化下和氧气水反应形成硫酸;
(2)由热化学方程式2SO2(g)+O2(g)?2SO3(g)△H=-196.6 kJ•mol-1①,
2NO(g)+O2(g)?2NO2(g)△H=-113.0 kJ•mol-1②,
根据盖斯定律①-②可得热化学方程式;
(3)①在图中由于Na+向a极区域移动,根据同种电荷相互排斥,异种电荷相互吸引的原则,a要连接电源的负极,b要连接电源的正极,在阳极上SO32-变为S042-,C口流出的物质是硫酸;
②在阳极上SO32-变为S042-;
③电解过程中若消耗12.6 g Na2SO3,n(Na2SO3)=$\frac{12.6g}{126g/mol}$=0.1 mol,则电子转移0.2 mol,在阴极发生反应:2H++2e-=H2↑,放出氢气0.1 mol,质量减轻0.2 g,同时移向该区域0.2 mol的Na+;
(4)①溶液中S032-水解:SO32-+H2O?HSO3-+OH-,破坏水的电离平衡,导致溶液显碱性,根据电荷守恒分析;
②常温下,亚硫酸氢钠呈酸性,说明亚硫酸氢根离子的电离程度大于水解程度,根据物料守恒得c(Na+)=c(H2SO3)+c(HSO3-)+c(SO32-)①,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-)②,两式计算得到.
解答 解:(1)大气中的SO2在烟尘的催化下形成硫酸的反应方程式是:2SO2+2H2O+O2$\frac{\underline{\;烟尘\;}}{\;}$2H2SO4,
故答案为:2SO2+2H2O+O2$\frac{\underline{\;烟尘\;}}{\;}$2H2SO4;
(2)由热化学方程式2SO2(g)+O2(g)?2SO3(g)△H=-196.6 kJ•mol-1①,
2NO(g)+O2(g)?2NO2(g)△H=-113.0 kJ•mol-1②,
根据盖斯定律①-②可得:NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8 kJ•mol-1,
故答案为:NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8 kJ•mol-1;
(3)①在图中由于Na+向a极区域移动,根据同种电荷相互排斥,异种电荷相互吸引的原则,a要连接电源的负极,b要连接电源的正极,在阳极上SO32-变为S042-,C口流出的物质是硫酸,
故答案为:负;硫酸;
②在阳极上SO32-变为S042-,SO32-放电的电极反应式为:SO32-+H2O=SO42-+2H+,
故答案为:SO32-+H2O=SO42-+2H+;
③电解过程中若消耗12.6 g Na2SO3,n(Na2SO3)=$\frac{12.6g}{126g/mol}$=0.1 mol,则电子转移0.2 mol,在阴极发生反应:2H++2e-=H2↑,放出氢气0.1 mol,质量减轻0.2 g,同时移向该区域0.2 mol的Na+,溶液增重4.6 g,故该区域的质量总增重4.4 g,
故答案为:4.4;
(4)①溶液中S032-水解:SO32-+H2O?HSO3-+OH-,破坏水的电离平衡,导致溶液显碱性,根据电荷守恒,溶液中c(H+)+c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-),故c(Na+)<2c(SO32-)+c(HSO3-)+c(OH-),
故答案为:SO32-+H2O?HSO3-+OH-,
②常温下,亚硫酸氢钠呈酸性,说明亚硫酸氢根离子的电离程度大于水解程度,根据物料守恒得c(Na+)=c(H2SO3)+c(HSO3-)+c(SO32-)①,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-)②,将方程式①代入②得,c(H2SO3)+c(H+)=c(OH-)+c(SO32-),所以c(SO32-)-c(H2SO3)=c(H+)-c(OH-)=(10-6-10-8)mol•L-1=9.9×10-7mol•L-1,
故答案为:9.9×10-7mol.
点评 本题考查了热化学方程式书写、电解池原理和电极反应书写、电解质溶液中电荷守恒、物料守恒等知识点的理解应用,掌握基础是解题关键,题目难度中等.

| A. | X、Y间可形成离子化合物 | |
| B. | 单质熔点:Y>W>X | |
| C. | 最高价氧化物对应水化物的酸性:Z>W | |
| D. | Y、W形成的单核离子均能破坏水的电离平衡 |
| A. | 某钠盐溶液含甲电离出的阴离子,则该溶液显碱性 | |
| B. | 乙中含有化合价为-1的元素 | |
| C. | 丙与氧气的摩尔质量相同,则丙可以是CH3OH | |
| D. | 若丁中含有2种元素且含有ⅣA族元素,则相同条件下丁比甲稳定 |
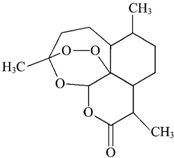
| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 该有机物属于烃 | |
| C. | 分子中含有醚键、酯基、甲基三种官能团 | |
| D. | 能发生加成反应和取代反应 |
| A. | 氢气与氯气应分别贮存在钢瓶中,并放在同一安全室集中保存 | |
| B. | 电石、Na2O2着火时,不能用常规的水枪灭火 | |
| C. | 可燃性颗粒(如面粉,漆粉)弥漫到空气中,可能会引起爆炸 | |
| D. | 油锅着火可用金属锅盖盖灭 |
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(CO2)/mol |
| 0 | 2.00 | 2.00 | 0 |
| 2 | 0.80 | ||
| 4 | 1.20 |
| A. | 反应在0~2 min内的平均速率为v(SO2)=0.6 mol•L-1•min-1 | |
| B. | 反应在2~4 min内容器内气体的密度没有变化 | |
| C. | 若升高温度,反应的平衡常数变为1.00,则正反应为放热反应 | |
| D. | 保持其他条件不变,起始时向容器中充入1.00 mol MgSO4和1.00 mol CO,到达平衡时n(CO2)<0.60 mol |
| 选项 | 实验操作 | 现象 | 结论或解释 |
| A | 将某钾盐固体溶于盐酸 | 产生无色无味的气体 | 该钾盐是K2CO3 |
| B | 向可能含有Fe2+的Fe2(SO4)3溶液中加入酸性KMnO4溶液 | KMnO4溶液褪色 | 该溶液中一定含有Fe2+ |
| C | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| D | 向浓度均为0.1 mol•L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |