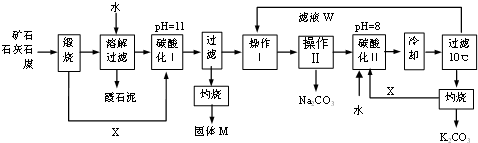
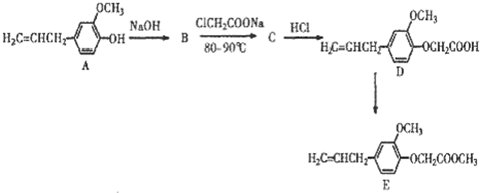
题目内容
一固体单质A加入NaOH溶液生成单质气体B和化合物甲,气体B和单质C在一定条件下反应生成化合物乙,化合物甲加入过量盐酸生成白色胶状物质丙,丙彻底脱去化合物乙生成难溶物丁,丁加入NaOH又可生成化合物甲,写出上述物质的化学式:A 、B 、C 、甲 乙 丙 丁 ,写出A与NaOH反应的化学方程式: 写出甲与盐酸反应的离子方程式: .
考点:无机物的推断
专题:
分析:能和NaOH溶液反应生成气体单质和化合物的有Si和Al,但NaAlO2和过量稀盐酸反应生成可溶性的AlCl3而得不到白色胶状物,但Na2SiO3和过量稀盐酸反应生成白色胶状物H2SiO3,所以A是Si、甲是Na2SiO3,硅酸脱水生成SiO2,则乙是H2O,丙是H2SiO3,丁是SiO2,所以B是H2、C是O2,SiO2属于酸性氧化物,和NaOH溶液反应生成Na2SiO3和水,据此分析解答.
解答:
解:能和NaOH溶液反应生成气体单质和化合物的有Si和Al,但NaAlO2和过量稀盐酸反应生成可溶性的AlCl3而得不到白色胶状物,但Na2SiO3和过量稀盐酸反应生成白色胶状物H2SiO3,所以A是Si、甲是Na2SiO3,硅酸脱水生成SiO2,则乙是H2O,丙是H2SiO3,丁是SiO2,所以B是H2、C是O2,SiO2属于酸性氧化物,和NaOH溶液反应生成Na2SiO3和水,
通过以上分析知,A、B、C、甲、乙、丙、丁分别是Si、H2、O2、Na2SiO3、H2O、H2SiO3、SiO2;
硅和NaOH溶液反应生成硅酸钠和氢气,反应方程式为Si+2NaOH+H2O=Na2SiO3+2H2↑,
硅酸钠和稀盐酸反应生成硅酸和氯化钠,离子方程式为SiO32-+2H+=H2SiO3↓,
故答案为:Si;H2;O2;Na2SiO3;H2O;H2SiO3;SiO2;Si+2NaOH+H2O=Na2SiO3+2H2↑;SiO32-+2H+=H2SiO3↓.
通过以上分析知,A、B、C、甲、乙、丙、丁分别是Si、H2、O2、Na2SiO3、H2O、H2SiO3、SiO2;
硅和NaOH溶液反应生成硅酸钠和氢气,反应方程式为Si+2NaOH+H2O=Na2SiO3+2H2↑,
硅酸钠和稀盐酸反应生成硅酸和氯化钠,离子方程式为SiO32-+2H+=H2SiO3↓,
故答案为:Si;H2;O2;Na2SiO3;H2O;H2SiO3;SiO2;Si+2NaOH+H2O=Na2SiO3+2H2↑;SiO32-+2H+=H2SiO3↓.
点评:本题以硅及其化合物之间的转化为载体考查无机物推断,侧重考查学生分析、推断能力,明确“化合物甲加入过量盐酸生成白色胶状物质丙”是解本题关键,很多同学往往将甲误认为是偏铝酸钠而导致错误,为易错题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
科学家已发现一种新型氢分子,其化学式为H3,在体积相同的两个密闭容器中充分充满H2、H3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
| A、两种气体的压强相等 |
| B、H2比H3的质量小 |
| C、两种气体的分子数目相等 |
| D、两种气体的氧原子数目相等 |
下列说法正确的是( )
| A、s能级的能量总是小于p能级的能量 |
| B、2s的电子云比1s的电子云大,说明2s的电子云中的电子比1s的多 |
| C、当电子排布在同一能级的不同轨道时,电子总是先占满1个轨道,然后再占据其他原子轨道 |
| D、nf能级中最多可容纳14个电子 |
如图所示与对应的叙述相符的是( )


| A、图Ⅰ可表示对于达到平衡状态的N2(g)+3H2(g)?2NH3(g)反应,在t1时缩小容器体积,并在t2时又达到平衡 |
| B、图Ⅱ可表示体积都为1L,pH=2的盐酸和醋酸溶液分别与0.65g锌粒反应生成氢气速率的快慢 |
| C、图Ⅲ表示NO2平衡转化率与温度、压强的变化关系,由图可知:△H<0、p1<p2 |
| D、图Ⅳ可表示将等体积pH=2的盐酸和醋酸分别加水稀释过程中pH的变化 |
下列水解的离子方程式正确的是( )
| A、NH4++H2O?NH3?H2O+H+ |
| B、Br-+H2O?HBr+OH- |
| C、CO32-+2H2O?H2CO3+2OH- |
| D、Fe3++3H2O?Fe(OH)3↓+3H+ |