题目内容
11.下列说法正确的是( )| A. | 正反应是放热反应的可逆反应,升高温度v(正)>v(逆) | |
| B. | 升高温度或使用催化剂是通过增加活化分子百分数而使反应速率加快 | |
| C. | 勒夏特列原理只使用于可逆反应,不使用于溶解和弱电解质的电离 | |
| D. | △G=△H-T△S适合任意条件的化学反应进行的方向判据 |
分析 A.正反应是放热反应的可逆反应,升高温度平衡逆向移动;
B.升高温度、加入催化剂都可增大活化分子百分数;
C.难溶电解质以及弱电解质都存在可逆过程;
D.△G=△H-T△S<0时可自发进行.
解答 解:A.正反应是放热反应的可逆反应,升高温度平衡逆向移动,则正反应速率小于逆反应速率,故A错误;
B.升高温度、加入催化剂都可增大活化分子百分数,可增大反应速率,故B正确;
C.难溶电解质以及弱电解质都存在可逆过程,适用于勒夏特列原理,故C错误;
D.△G=△H-T△S<0时可自发进行,温度、反应热以及熵变影响反应能否自发进行,故D错误.
故选B.
点评 本题考查较为综合,涉及化学平衡的影响因素以及反应热与焓变,为高频考点,侧重于双基的考查,注意把握外界条件下对平衡移动的影响,难度不大.

练习册系列答案
相关题目
1.羰基硫(COS)可用作粮食熏蒸剂,可由CO 与H2S 在一定条件下反应制得.在恒容的密闭容器中发生反应并达到平衡:CO(g)+H2S(g)?COS(g)+H2(g),数据如表所示:
下列说法正确的是( )
| 实验 | 温度/℃ | 起始时 | 平衡时 | |||
| n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
| 1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
| 2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
| 3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
| A. | 上述反应是吸热反应 | |
| B. | 实验1 达平衡时,CO 的转化率为70% | |
| C. | 实验2 达平衡时,a<7.0 | |
| D. | 实验3 达平衡后,再充入1.0molH2,K 值增大,平衡逆向移动 |
2.下列实验操作的描述中,正确的是( )
| A. | 过滤时,慢慢地将液体直接倒入过滤器中 | |
| B. | 在食盐溶液蒸发结晶的过程中,当蒸发皿中出现较多量固体时即停止加热 | |
| C. | 酒精灯不慎碰倒起火时可用水扑灭 | |
| D. | 先在天平两个托盘上各放一张相同质量的纸,再把NaOH固体放在纸上称量 |
19.下列说法正确的是( )
| A. | 25℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V(醋酸)<V(NaOH) | |
| B. | 稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小 | |
| C. | 常温下将pH=3稀醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| D. | 25℃时,amol/L一元酸与bmol/LNaOH等体积混合后,pH=7,所得混合溶液中一定有c(A-)=c(NA+) |
6.0.1mol•L-1氨水10mL,加蒸馏水稀释到1L后,下列变化中正确的是( )
①电离程度增大 ②c(NH3•H2O)增大 ③NH4+数目增多 ④c(OH-)增大 ⑤导电性增强.
①电离程度增大 ②c(NH3•H2O)增大 ③NH4+数目增多 ④c(OH-)增大 ⑤导电性增强.
| A. | ①②③ | B. | ①③⑤ | C. | ①③ | D. | ②④ |
16.下列判断正确的是( )
| A. | pH=6的溶液一定呈酸性 | |
| B. | c(H+)水电离产生=c(OH-)水电离产生的溶液一定呈中性 | |
| C. | 使石蕊试液显红色的溶液一定呈酸性 | |
| D. | 强酸和强碱等物质的量混合后溶液一定呈中性 |
3.下列现象是因为发生取代反应的是( )
| A. | 乙烯使酸性KMnO4溶液褪色 | |
| B. | 乙烯使溴水褪色 | |
| C. | 点燃乙烯出现黑烟 | |
| D. | 甲烷与氯气的混合气体,光照一段时间后褪色 |
20.下列说法正确的是( )
| A. | CuSO4•5H2O是一种纯净物 | |
| B. | 溶于水后能电离出氢离子的化合物一定是酸 | |
| C. | 氯化钠溶液在电流作用下电离成钠离子和氯离子 | |
| D. | SO3、NH3的水溶液均能导电,所以均是电解质 |
15.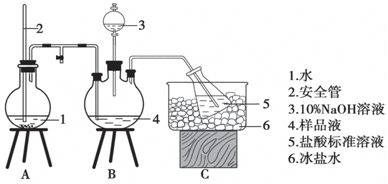 某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.
某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL c1 mol•L-1的盐酸标准溶液吸收.蒸氨结束后取下接收瓶,用c2 mol•L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液.
②氯的测定
回答下列问题:
(1)装置中安全管的作用原理是使A瓶中压强稳定.
(2)用NaOH标准溶液滴定过剩的HCl时,应使用碱式滴定管,可使用的指示剂为酚酞或甲基橙.
(3)样品中氨的质量分数表达式为$\frac{(C{\;}_{1}V{\;}_{1}-C{\;}_{2}V{\;}_{2})×10{\;}^{-3}×17}{w}$×100%.
(4)测定氨前应该对装置进行气密性检查,若气密性不好测定结果将偏低(填“偏高”或“偏低”).
(5)氯的测定采用莫尔法,莫尔法是一种沉淀滴定法,用标准硝酸银溶液滴定,进行测定溶液中Cl-的浓度.已知:
①若用AgNO3溶液滴定待测液,可选为滴定指示剂的是C.
A.NaCl B.BaBr2 C.Na2CrO4 D.KSCN
②滴定终点的现象是滴入最后一滴标准溶液,生成砖红色沉淀,且30s 不复原.
 某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.
某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL c1 mol•L-1的盐酸标准溶液吸收.蒸氨结束后取下接收瓶,用c2 mol•L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液.
②氯的测定
回答下列问题:
(1)装置中安全管的作用原理是使A瓶中压强稳定.
(2)用NaOH标准溶液滴定过剩的HCl时,应使用碱式滴定管,可使用的指示剂为酚酞或甲基橙.
(3)样品中氨的质量分数表达式为$\frac{(C{\;}_{1}V{\;}_{1}-C{\;}_{2}V{\;}_{2})×10{\;}^{-3}×17}{w}$×100%.
(4)测定氨前应该对装置进行气密性检查,若气密性不好测定结果将偏低(填“偏高”或“偏低”).
(5)氯的测定采用莫尔法,莫尔法是一种沉淀滴定法,用标准硝酸银溶液滴定,进行测定溶液中Cl-的浓度.已知:
| 银盐 性质 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| 溶解度(mol•L-1) | 1.3410-6 | 7.110-7 | 1.110-8 | 6.510-5 | 1.010-6 |
A.NaCl B.BaBr2 C.Na2CrO4 D.KSCN
②滴定终点的现象是滴入最后一滴标准溶液,生成砖红色沉淀,且30s 不复原.