题目内容
3.完全燃烧一定质量的乙醇.放出的热量为a kJ,将生成的二氧化碳通人澄清石灰水中,生成20g白色沉淀,则乙醇的燃烧热为多少?分析 燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,二氧化碳与足量的氢氧化钙完全反应,生成不溶于水的白色沉淀碳酸钙,利用生成碳酸钙的质量计算燃烧生成二氧化碳的质量,乙醇燃烧,乙醇中的碳全部转化为二氧化碳,利用二氧化碳的量计算乙醇的物质的量,根据放出的热量为a kJ,计算乙醇的燃烧热.
解答 解:设燃烧产物中CO2的质量为x.
CO2+Ca(OH)2=CaCO3↓+H2O
44 100
x 20g
x=8.8g,n(CO2)=$\frac{m}{M}$=$\frac{8.8g}{44g/mol}$=0.2mol,乙醇燃烧,乙醇中的碳全部转化为二氧化碳,C2H5OH+3O2$\stackrel{点燃}{→}$2CO2+3H2O,则n(C2H5OH)=$\frac{1}{2}$n(CO2)=0.1mol,放出的热量为a kJ,燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,则乙醇的燃烧热为10aKJ/mol,
答:乙醇的燃烧热为10aKJ/mol.
点评 本题考查了燃烧热概念的理解应用,根据方程式进行计算以及正确理解燃烧热是解答关键,题目较简单.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
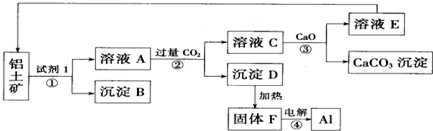
13.将铁粉加入到一定量AgNO3、Cu(NO3)2的混合溶液中,充分反应后过滤,向滤渣中加入稀盐酸发现有气体逸出,则滤渣的组成为( )
| A. | 铁 | B. | 铁和铜 | C. | 铁和银 | D. | 铁、铜、银 |
14.某水溶液中可能含有Na+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-离子中的若干种.某同学取200mL该溶液分成两等份依次进行如下实验:①向第一份溶液中加过量的NaOH溶液后加热,充分反应后生成0.02mol气体,无沉淀产生,同时得到溶液甲.②向溶液甲中通入过量的CO2气,充分反应生成白色沉淀,沉淀经过滤、洗涤、灼烧至恒重得到1.02g固体.③向第二份溶液中加入足量的BaCl2溶液,充分反应生成白色沉淀,沉淀用盐酸充分洗涤、干燥,得到11.65g固体.据此,该同学得到的结论正确的是( )
| A. | 实验①中产生的气体为氨,并可得原溶液中c(NH4+)=0.1 mol•L-1 | |
| B. | 实验③中的沉淀里一定有BaSO4,可能有Mg(OH)2 | |
| C. | 若要确定原溶液中是否含有Cl-,无需另外再设计实验验证 | |
| D. | 原溶液中一定含有Na+,且c(Na+)≥0.2 mol•L-1 |
11.下列操作或装置能达到实验目的是( )
| A. | 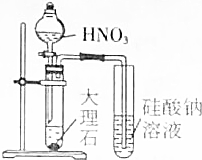 证明HNO3酸性比H2CO3强 | B. | 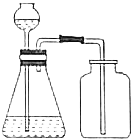 实验室用二氧化锰和盐酸制氯气 | ||
| C. | 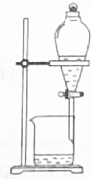 分离溴苯和苯 | D. | 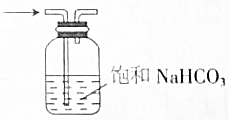 除去CO2中SO2 |
8.氧化还原反应在生活中普遍存在,下列事实中不涉及氧化还原反应的是( )
| A. | 金属锈蚀 | B. | 烟花燃放 | C. | 食物腐败 | D. | 水垢形成 |
1.食醋的主要成分是乙酸,下列物质中,能与乙酸发生反应的是( )
①石蕊 ②乙醇 ③氢氧化铜 ④金属铝 ⑤氧化镁 ⑥碳酸钙.
①石蕊 ②乙醇 ③氢氧化铜 ④金属铝 ⑤氧化镁 ⑥碳酸钙.
| A. | ①③④⑤⑥ | B. | ②③④⑤ | C. | ①②④⑤⑥ | D. | 全部 |
2.不能发生铝热反应的是( )
| A. | V2O5 | B. | Cr2O3 | C. | MnO2 | D. | MgO |