题目内容
18. 甲醇被称为2l世纪的新型燃料,工业上通过下列反应①②,用CH4和H2O为原料来制备甲醇.
甲醇被称为2l世纪的新型燃料,工业上通过下列反应①②,用CH4和H2O为原料来制备甲醇.①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1
②CO(g)+2H2(g)?CH3OH(g)△H2
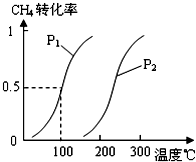
将0.20mol CH4(g)和0.30mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图.
(1)温度不变,缩小体积,增大压强,①的反应速率增大(填“增大”、“减小”或“不变”),
平衡向逆反应(填“正反应”或“逆反应”)方向移动.
(2)温度升高,反应①的△H1>0(填“<”、“=”或“>”),其平衡常数表达式为K=$\frac{c(CO)•{c}^{3}({H}_{2})}{c(C{H}_{4})•c({H}_{2}O)}$,100℃时平衡常数的数值是1.35×10-3.
分析 (1)温度不变,缩小体积增大压强,反应速率增大,平衡向气体体积减小的方向移动;
(2)采取控制变量法分析,由图可知压强相同时,到达平衡时,温度越高CH4的转化率越大,升高温度平衡向正反应移动;
化学平衡常数等于生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
利用三段法计算出100℃时各物质的平衡浓度,带入平衡常数表达式计算.
解答 解:(1)温度不变,缩小体积增大压强,反应速率增大,平衡向气体体积减小的方向移动,即反应①向逆反应方向移动,
故答案为:增大;逆反应;
(2)采取控制变量法分析,由图可知压强相同时,到达平衡时,温度越高CH4的转化率越大,升高温度平衡向正反应移动,故正反应为吸热反应,即△H>0;
CH4(g)+H2O(g)?CO(g)+3H2(g)的K=$\frac{c(CO)•{c}^{3}({H}_{2})}{c(C{H}_{4})•c({H}_{2}O)}$;
CH4(g)+H2O(g)?CO(g)+3H2(g)
起始(mol):0.20 0.30 0 0
转化(mol):0.10 0.10 0.10 0.30
平衡(mol):0.10 0.20 0.10 0.30
平衡(mol/L):0.01 0.02 0.01 0.03
100℃时,K=$\frac{c(CO)•{c}^{3}({H}_{2})}{c(C{H}_{4})•c({H}_{2}O)}$=$\frac{0.01×0.0{3}^{3}}{0.01×0.02}$=1.35×10-3,
故答案为:>;$\frac{c(CO)•{c}^{3}({H}_{2})}{c(C{H}_{4})•c({H}_{2}O)}$;1.35×10-3.
点评 本题考查化学平衡图象、反应速率计算、化学平衡常数的有关计算、化学平衡的影响因素等,为高频考点,难度中等,平时学习中要加强计算能力的培养.

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案| A. | H2SO4的摩尔质量是98g | |
| B. | 标况下,H2的摩尔体积是22.4L | |
| C. | 将1mol NaCl溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2mol/L | |
| D. | 氧气的摩尔质量与它的相对分子质量在数值上相等 |
| A. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| B. | 遇苯酚显紫色的溶液:I-、K+、SCN-、Mg2+ | |
| C. | 由水电离出的c(H+)c(OH-)═10-22的溶液:Fe2+、Na+、NO3-、SO42- | |
| D. | 澄清透明的溶液中SO42-、K+、Cu2+、Cl- |
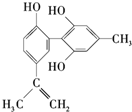 体育比赛中坚决反对运动员服用兴奋剂,倡导公平竞赛.某种兴奋剂P的结构简式如图所示,下列有关该物质的说法中正确的是( )
体育比赛中坚决反对运动员服用兴奋剂,倡导公平竞赛.某种兴奋剂P的结构简式如图所示,下列有关该物质的说法中正确的是( )| A. | 兴奋剂P遇FeCl3溶液显紫色,说明P是苯酚的同系物 | |
| B. | 兴奋剂P能使酸性KMnO4溶液的紫色褪去,说明P分子中存在碳碳双键 | |
| C. | 兴奋剂P在一定条件下可以发生取代、加成、加聚、氧化、还原、消去等反应 | |
| D. | 1mol P分别与浓溴水和H2反应时最多消耗的Br2和H2分别为4mol和7mol |

(1)A中发生反应的离子方程式是CaCO3+2H+=Ca2++H2O+CO2↑.
(2)填写表中空格.
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| D |
(4)C中反应的化学方程式是2Na2O2+2CO2=2Na2CO3+O2.
| A. | $\frac{5000(2b-a)}{V}$mol/L | B. | $\frac{5(2b-a)}{V}$mol/L | C. | $\frac{(2b-a)}{V}$mol/L | D. | $\frac{1000(2b-a)}{V}$mol/L |