题目内容
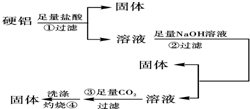 硬铝中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如图所示实验:
硬铝中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如图所示实验:完成上述第①②③步反应的离子方程式及第④步的化学方程式:
①
③
考点:探究物质的组成或测量物质的含量,离子方程式的书写,铝的化学性质
专题:几种重要的金属及其化合物
分析:由测定该合金中铝的含量流程可知,①加盐酸,Cu、Si不反应,则过滤得到的固体为Cu、Si,溶液中含Al3+、Mg2+,②加足量的NaOH,过滤得到的沉淀为Mg(OH)2,溶液中主要含AlO2-,③通足量的二氧化碳,反应生成Al(OH)3,④灼烧得到Al2O3,然后结合物质的性质及化学用语来解答.
解答:
解:由测定该合金中铝的含量流程可知,①加盐酸,Cu、Si不反应,则过滤得到的固体为Cu、Si,溶液中含Al3+、Mg2+,②加足量的NaOH,过滤得到的沉淀为Mg(OH)2,溶液中主要含AlO2-,③通足量的二氧化碳,反应生成Al(OH)3,④灼烧得到Al2O3,
①由上述分析可知,第①步转化中的离子反应为Mg+2H+=Mg2++H2↑、2Al+6H+=2Al3++3H2↑,
故答案为:Mg+2H+=Mg2++H2↑;2Al+6H+=2Al3++3H2↑;
②由上述分析可知,第②步转化中的离子反应为Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,
故答案为:Mg2++2OH-=Mg(OH)2↓;Al3++3OH-=Al(OH)3↓;
③中的离子反应为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
④中的化学反应为2Al(OH)3
Al2O3+3H2O,故答案为:2Al(OH)3
Al2O3+3H2O.
①由上述分析可知,第①步转化中的离子反应为Mg+2H+=Mg2++H2↑、2Al+6H+=2Al3++3H2↑,
故答案为:Mg+2H+=Mg2++H2↑;2Al+6H+=2Al3++3H2↑;
②由上述分析可知,第②步转化中的离子反应为Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,
故答案为:Mg2++2OH-=Mg(OH)2↓;Al3++3OH-=Al(OH)3↓;
③中的离子反应为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
④中的化学反应为2Al(OH)3
| ||
| ||
点评:本题考查测定合金中铝的含量,为高频考点,把握常见金属的性质及测定流程中发生的反应为解答的关键,侧重Al、Mg、Cu、Si的单质及化合物与酸、碱反应的考查,题目难度不大.

练习册系列答案
相关题目
用铝热剂冶炼难熔金属,最主要是因为( )
| A、铝具有导热性 |
| B、铝氧化时放出大量的热 |
| C、铝是还原剂 |
| D、铝具有两性 |
除去铁粉中少量的铝粉,可选用的试剂是( )
| A、氨水 | B、氢氧化钠溶液 |
| C、硫酸溶液 | D、盐酸 |
和空气接触可发生非氧化还原反应的物质组合是( )
①Na ②Na2SiO3溶液 ③Na2O2 ④烧碱溶液 ⑤石灰水 ⑥Fe(OH)2.
①Na ②Na2SiO3溶液 ③Na2O2 ④烧碱溶液 ⑤石灰水 ⑥Fe(OH)2.
| A、①③④ | B、②④⑤ |
| C、②③⑥ | D、①④⑤ |