题目内容
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按如图进行反应.又知E溶液是无色的,A为变价金属.请回答:
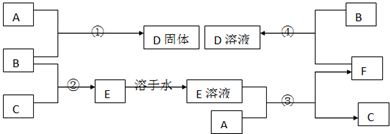
(1)A是 、B是 、C是 (请填化学式).
(2)反应①的化学方程式为: .
(3)反应④的化学方程式为: .
(4)如何检验D溶液溶质的阳离子?写出所需的试剂及实验现象 .

(1)A是
(2)反应①的化学方程式为:
(3)反应④的化学方程式为:
(4)如何检验D溶液溶质的阳离子?写出所需的试剂及实验现象
考点:无机物的推断
专题:推断题
分析:B为黄绿色气体,应为Cl2,A为变价金属,应为Fe,则D为FeCl3,F能与Cl2反应生成FeCl3,则F应为FeCl2,则E为HCl的水溶液,C为H2,结合物质的相关性质解答该题.
解答:
解:B为黄绿色气体,应为Cl2,A为变价金属,应为Fe,则D为FeCl3,F能与Cl2反应生成FeCl3,则F应为FeCl2,则E为HCl的水溶液,C为H2,
(1)由以上分析可知,A为Fe,B为Cl2,C为H2,故答案为:Fe;Cl2;H2;
(2)反应①为Fe和Cl2的反应,反应的化学方程式为2Fe+3Cl2
2FeCl3,故答案为:2Fe+3Cl2
2FeCl3;
(3)反应④为FeCl2和Cl2的反应,反应的化学方程式为2FeCl2+Cl2=2FeCl3,故答案为:2FeCl2+Cl2=2FeCl3;
(4)D为FeCl3,含有Fe3+,可与KSCN发生显色反应,溶液变成红色,
故答案为:取样于小试管中,加入硫氰化钾溶液后,溶液变为血红色.
(1)由以上分析可知,A为Fe,B为Cl2,C为H2,故答案为:Fe;Cl2;H2;
(2)反应①为Fe和Cl2的反应,反应的化学方程式为2Fe+3Cl2
| ||
| ||
(3)反应④为FeCl2和Cl2的反应,反应的化学方程式为2FeCl2+Cl2=2FeCl3,故答案为:2FeCl2+Cl2=2FeCl3;
(4)D为FeCl3,含有Fe3+,可与KSCN发生显色反应,溶液变成红色,
故答案为:取样于小试管中,加入硫氰化钾溶液后,溶液变为血红色.
点评:本题考查无机物的推断,题目难度不大,本题注意根据物质的性质、特征作为突破口进行推断,学习中注意牢固把握元素化合物的性质,不要忽视物质的用途.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
用mol作为单位的物理量是( )
| A、长度 | B、质量 |
| C、物质的量 | D、物质的量浓度 |
NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A、1mo1的Fe在1mo1Cl2中充分燃烧,转移电子数为3NA |
| B、7.2g CaO2中的阴离子含有的电子数为1.0NA |
| C、标准状况下,6.72L NO2与水充分反应转移的电子数目为0.2NA |
| D、标准状况下,22.4L盐酸含有2NA个离子 |
将30mL 0.5mol/L的CuSO4溶液加水稀释到500mL,稀释后的CuSO4物质的量浓度为( )
| A、0.3mol/L |
| B、0.03mol/L |
| C、0.05mol/L |
| D、0.04mol/L |
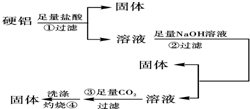 硬铝中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如图所示实验:
硬铝中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如图所示实验: