题目内容
除去铁粉中少量的铝粉,可选用的试剂是( )
| A、氨水 | B、氢氧化钠溶液 |
| C、硫酸溶液 | D、盐酸 |
考点:物质的分离、提纯的基本方法选择与应用,铝的化学性质,铁的化学性质
专题:化学实验基本操作
分析:铝既可与酸反应,也可与强碱反应,根据二者性质的异同选择分离方法,以此解答.
解答:
解:铁粉和铝粉都是活泼金属,都能和酸反应和弱碱不反应;但铝粉和铁粉的不同化学性质是:铝粉能和强碱反应生成盐和氢气,而铁粉和强碱不反应,则可用氢氧化钠溶液除杂,
故选B.
故选B.
点评:本题考查物质的分离、提纯,为高考常见题型,除杂时要注意不能引入新的杂质,更不能影响被提纯的物质,难度不大.

练习册系列答案
相关题目
镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点.有一种镁原电池的反应为:Mg+Mo3S4
MgxMo3S4,下列说法错误的是( )
| 放电 |
| 充电 |
| A、放电时Mg2+向正极迁移 |
| B、放电时的正极反应为:Mo3S4+2xe-=Mo3S42x- |
| C、充电时阴极的电极反应为:xMg2++2xe-=xMg |
| D、放电时镁为电池的负极,发生还原反应 |
下列离子方程式书写正确的是( )
| A、过量的SO2通入NaOH溶液中:SO2+2OH-=SO32-+H2O |
| B、NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3+2H2O+CO32- |
| C、向氯化铝溶液中加过量氨水:Al3++4NH3.H2O=AlO2-+4NH4++2H2O |
| D、FeSO4酸性溶液暴露在空气中:Fe2++O2+4H+=4Fe3++2H2O |
氧化亚铁固体可溶于足量稀硝酸,其中稀硝酸所体现的作用是( )
| A、还原性和酸性 |
| B、氧化性和酸性 |
| C、只有氧化性 |
| D、只有酸性 |
NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A、1mo1的Fe在1mo1Cl2中充分燃烧,转移电子数为3NA |
| B、7.2g CaO2中的阴离子含有的电子数为1.0NA |
| C、标准状况下,6.72L NO2与水充分反应转移的电子数目为0.2NA |
| D、标准状况下,22.4L盐酸含有2NA个离子 |
可以判定某酸HA是弱电解质的事实是( )
| A、HA能与水以任意比互溶 |
| B、0.1mol?L-1HA溶液的pH约为3 |
| C、HA可与NaHCO3反应放出CO2 |
| D、HA溶液的导电能力很差 |
将30mL 0.5mol/L的CuSO4溶液加水稀释到500mL,稀释后的CuSO4物质的量浓度为( )
| A、0.3mol/L |
| B、0.03mol/L |
| C、0.05mol/L |
| D、0.04mol/L |
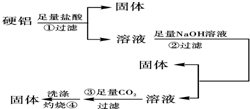 硬铝中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如图所示实验:
硬铝中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如图所示实验: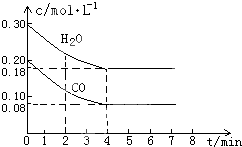 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示反应物的转化率越
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示反应物的转化率越