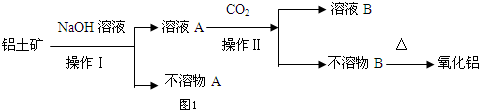
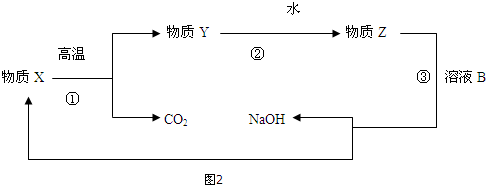
题目内容
18.将KCl和KBr的混合物13.4g溶于水配成500mL溶液,通入过量的Cl2,反应后将溶液蒸干,得到固体11.175g,则原来所配溶液中K+、Cl-、Br-的物质的量浓度之比为( )| A. | 1:2:3 | B. | 1:3:2 | C. | 2:3:1 | D. | 3:2:1 |
分析 溶液呈电中性,则原来所配溶液中K+、Cl-、Br-的物质的量浓度满足:c(K+)=c(Cl-)+c(Cl-),据此对各选项进行判断即可.
解答 解:将KCl和KBr的混合物13.4g溶于水配成500mL溶液,溶液中K+、Cl-、Br-的物质的量浓度满足:c(K+)=c(Cl-)+c(Cl-),
选项中A、B、C不符合,只有D满足电荷守恒,
故选D.
点评 本题考查了混合物反应的计算,题目难度不大,根据电荷守恒得出“c(K+)=c(Cl-)+c(Cl-)”为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
9.下列说法错误的是( )
①酸性氧化物不一定是非金属氧化物
②不能跟酸反应的氧化物一定能跟碱反应
③碱性氧化物肯定是金属氧化物
④乙酸乙酯在碱性条件下水解称为取代反应或者皂化反应
⑤浊液均可用过滤的方法分离.
①酸性氧化物不一定是非金属氧化物
②不能跟酸反应的氧化物一定能跟碱反应
③碱性氧化物肯定是金属氧化物
④乙酸乙酯在碱性条件下水解称为取代反应或者皂化反应
⑤浊液均可用过滤的方法分离.
| A. | ①③④ | B. | ②③④ | C. | ②④⑤ | D. | ①④⑤ |
6.下列溶液中不存在配离子的是( )
| A. | CuSO4水溶液 | B. | 银氨溶液 | C. | 硫氰化铁溶液 | D. | I2的CCl4溶液 |
3.下列物质中属于电解质并能导电的是( )
| A. | 液态氢氧化钾 | B. | 液态氯化氢 | C. | 氯化钠溶液 | D. | 碳棒 |
10.下列有关化学用语正确的是( )
| A. | 26Fe的价层电子排布式为3d64s2 | |
| B. | 35Br的电子排布式可简写为[Ar]4s24p5 | |
| C. | NH4Cl的电子式为 | |
| D. | 某基态原子核外电子排布图为: |
7.下列各组离子在给定条件下能大量共存的是( )
| A. | 在pH<5的溶液中:NH4+、K+、CH3COO-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 在酸性且为无色透明的溶液中:K+、Ba2+、Fe2+、Br- | |
| D. | 在滴加石蕊变蓝的溶液中:Na+、S2-、CO32-、K+ |
1. 已知某可逆反应mA(g)+nB(g)?qC(g)△H在密闭容器中进行.如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况.下列推断中正确的是( )
已知某可逆反应mA(g)+nB(g)?qC(g)△H在密闭容器中进行.如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况.下列推断中正确的是( )
 已知某可逆反应mA(g)+nB(g)?qC(g)△H在密闭容器中进行.如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况.下列推断中正确的是( )
已知某可逆反应mA(g)+nB(g)?qC(g)△H在密闭容器中进行.如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况.下列推断中正确的是( )| A. | p1>p2,T1<T2,m+n>q,△H<0 | B. | p1<p2,T1>T2,m+n>q,△H<0 | ||
| C. | p1>p2,T1<T2,m+n<q,△H<0 | D. | p1<p2,T1>T2,m+n<q,△H>0 |