题目内容
铜片放入热的稀硫酸中无明显现象,当加入下列哪种物质后现象有明显变化的是( )
| A、NaNO3 |
| B、HCl |
| C、NaOH |
| D、KCl |
考点:铜金属及其重要化合物的主要性质
专题:几种重要的金属及其化合物
分析:根据铜的化学性质,如:铜不能与非氧化性酸(硫酸)反应,但可以和氧化性酸(硝酸)反应,据此分析即可.
解答:
解:根据铜与稀硫酸不反应,加硝酸钠后,引入了硝酸根(与氢离子构成稀HNO3),铜与硝酸可以反应,即反应的离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,可知形成蓝色溶液且有气体放出,
故选A.
故选A.
点评:本题主要考查了金属铜的化学性质,对于铜和硝酸的反应要特别注意,可以直接加硝酸也可以分步产生:先加非氧化性酸(如盐酸、稀硫酸)后加硝酸盐.

练习册系列答案
相关题目
下列物质属于电解质的是( )
①碱石灰 ②熔融NaCl ③石灰水 ④NaOH ⑤液态氧 ⑥KClO3.
①碱石灰 ②熔融NaCl ③石灰水 ④NaOH ⑤液态氧 ⑥KClO3.
| A、①②④⑥ | B、②④⑤⑥ |
| C、②④⑥ | D、①②④⑤⑥ |
如果将质量相同的铜片在酒精灯上加热后,趁热加入下列物质中,放置片刻,Cu片质量与原来相比减小的是( )
| A、盐酸 |
| B、CO |
| C、NaOH |
| D、C2H5OH |
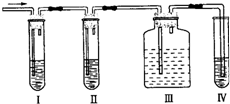 某混合气体可能是乙烯和二氧化硫的混合气,有人设计下列实验图以确认上述混合气体中有CH2=CH2和SO2.Ⅰ、Ⅱ、Ⅲ、Ⅳ装置中盛放的试剂依次是:品红溶液、NaOH溶液、品红溶液、酸性KMnO4溶液.回答下列问题:
某混合气体可能是乙烯和二氧化硫的混合气,有人设计下列实验图以确认上述混合气体中有CH2=CH2和SO2.Ⅰ、Ⅱ、Ⅲ、Ⅳ装置中盛放的试剂依次是:品红溶液、NaOH溶液、品红溶液、酸性KMnO4溶液.回答下列问题: