题目内容
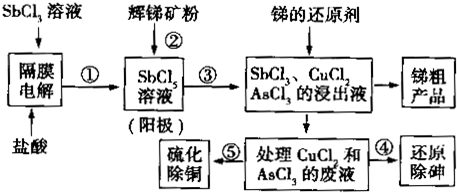
8.已知粗铜中含有少量的锌、铁、银、金等金属和其它杂质(杂质与酸不反应).(1)电解精炼铜后所得的阳极泥的综合利用:
①用稀硝酸处理阳极泥得到硝酸银稀溶液,写出该步反应的离子方程式:3Ag+4H++NO3-=3Ag++NO↑+2H2O
②残渣含有极少量的黄金.经过查阅有关资料,了解到一些有关金的知识如下:
| 序号 | 反应 | 化学平衡常数 |
| 1 | Au+6HNO3(浓)?Au(NO3)3+3NO2↑+3H2O | <<1 |
| 2 | Au3++4Cl-=AuCl4- | >>1 |
(2)电解后废液的测定:以下是该小组探究废液的一个实验流程:

①锌同铝一样,都是活泼金属,其氢氧化物既能溶于强酸生成Zn2+,又能溶于强碱生成ZnO22-.写出锌和氢氧化钠溶液反应的离子方程式Zn+2OH-+2H2O=[Zn(OH)4]2-+H2↑
②100mL废液中Cu2+的浓度为0.5mol•L-1,Fe2+的浓度为0.1mol•L-1.
分析 (1)①阳极泥中的Ag与稀硝酸反应生成硝酸银、一氧化氮和水;
②金属银可以和硝酸反应得到硝酸银以及水和一氧化氮;金离子可以和氯离子之间发生反应,形成稳定的AuCl4-离子,可以根据化学平衡移动原理来解释;
(2)①锌和氢氧化钠的反应与金属铝和氢氧化钠的反应相似;
②100mL的滤液中含有亚铁离子、铜离子、锌离子,当加入足量的金属Fe以后,会将金属铜全部置换出来,所以生成的3.2g金属是Cu,亚铁离子和氢氧化钠反应生成氢氧化亚铁,在空气中更易被氧化为氢氧化铁,受热分解生成的氧化铁的质量是4.8g,结合原子守恒计算.
解答 解:(1)①在电解精炼铜时,阳极反应是锌、铁、Cu等先失电子,阴极上是铜离子得电子产生铜,Cu2++2e=Cu,阳极泥中的Ag可以和稀硝酸反应生成硝酸银、一氧化氮和水,即3Ag+4H++NO3-=3Ag++NO↑+2H2O,
故答案为:3Ag+4H++NO3-=3Ag++NO↑+2H2O;
②根据表中的信息,Au+6HNO3(浓)═Au(NO3)3+3NO2↑+3H2O,并且Au3++4Cl-═AuCl4-,在王水中,含有浓硝酸和浓盐酸,浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的AuCl4-离子,使反应2平衡向右移动,则金溶于王水中,
故答案为:浓盐酸含有大量氯离子,Au3+离子与氯离子形成稳定的AuCl4-离子,使反应1平衡向右移动,则金溶于王水中;
(2)①根据题干信息得锌和氢氧化钠溶液反应的化学方程式为:Zn+2NaOH+2H2O=Na2[Zn(OH)4]+H2↑,其反应的离子方程式为:Zn+2OH-+2H2O=[Zn(OH)4]2-+H2↑;
故答案为:Zn+2OH-+2H2O=[Zn(OH)4]2-+H2↑;
②100mL的滤液中含有亚铁离子、铜离子、锌离子,当加入足量的金属Fe以后,会将金属铜全部置换出来,所以生成的3.2g金属是Cu,所以铜离子的浓度c=$\frac{n}{V}$=$\frac{\frac{3.2}{64}mol}{0.1L}$mol/L=0.5 mol/L,
亚铁离子和氢氧化钠反应生成氢氧化亚铁,在空气中更易被氧化为氢氧化铁,受热分解生成的氧化铁的质量是4.8g,根据原子守恒,亚铁离子的物质的量是:$\frac{4.8g}{160g/mol}$×2=0.06mol,所以加入铁粉后的滤液中亚铁离子的浓度c=$\frac{n}{V}$=$\frac{0.06mol}{0.1L}$=0.6mol/L,由于加入了铁粉,铁与溶液中的铁离子反应生成了亚铁离子,所以100mL滤液中亚铁离子的浓度为:0.6mol/L-0.5 mol/L=0.1mol/L,
故答案为:0.5;0.1.
点评 本题考查了反应原理和元素化合物的性质,涉及了电解精炼铜、化学平衡移动原理以及、有关物质的量的计算、金属元素化合物的性质,题目考查角度广,难度中等,注意把握平衡原理的应用以及原子守恒在计算中的应用方法.

| A. | 某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 | |
| B. | 今年5月18日桐庐县320国道化学品运输车侧翻造成1,1,2,2-四氯乙烷泄漏,该有机物是一种重要的有机溶剂,不溶于水且密度比水小 | |
| C. | 如图所示的有机物分子式为C14H12O2,此有机物能与NaHCO3溶液反应放出CO2气体 | |
| D. | 化合物  在酸性条件下水解,所得溶液加碱后加热有NH3生成 在酸性条件下水解,所得溶液加碱后加热有NH3生成 |
| A. | 同质量、同密度的O2和NO | B. | 同质量、不同密度的NO和C2H6 | ||
| C. | 同体积、同压强的CO和C2H4 | D. | 同温度、同体积的N2和O2 |
| A. | 石灰水 | B. | 豆浆 | C. | 泥水 | D. | 蔗糖水 |
| A. | 二氧化碳 | B. | 总悬浮颗粒 | C. | 二氧化硫 | D. | 氮氧化物 |
| A. | 标准状况下,22.4 L水中所含原子总数为3NA | |
| B. | 常温常压下,44 gC3H8中含有的碳碳单键数为3NA | |
| C. | 标准状况下,44.8 L NO与22.4L O2混合后,气体分子总数为3NA | |
| D. | 1 molNa2O和Na2O2混合物中含有的阴.阳离子总数是3NA |
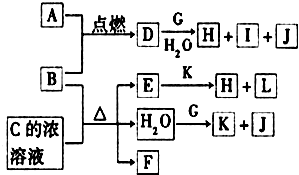 图中,A~L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕黄色烟,B、G为中学化学中常见的金属单质,E的稀溶液为蓝色,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味的气体,且能使品红溶液褪色.
图中,A~L为常见物质或该物质的水溶液,B在A气体中燃烧产生棕黄色烟,B、G为中学化学中常见的金属单质,E的稀溶液为蓝色,I的焰色反应为黄色,组成J的元素原子核内只有一个质子,F为无色、有刺激性气味的气体,且能使品红溶液褪色.