题目内容
17.(1)25℃时,浓度为0.1mol•L-1的6种溶液:①HCl,②CH3OOH,③Ba(OH)2,④Na 2CO3,⑤KCl,⑥NH4Cl溶液pH由小到大的顺序为①②⑥⑤④③(填写编号).(2)25℃时,醋酸的电离常数Ka=1.7×10-5mol/L,则该温度下CH3COONa的水解平衡常数Kh=5.9×10-10mol•L-1(保留到小数点后一位).
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈酸性(填“酸性”,“中性”或“碱性”),请写出离子浓度大小关系式:c(Na+)+c(H+)=c(CH3COO-)+c(OH-).
(4)25℃时,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后,溶液的pH=7,
则溶液中c(CH3COO-)+c(CH3COOH)=0.5mmol/L,m与n的大小关系是m>n(填“>”“=”或“<”).
分析 (1)先将物质的按照碱、盐、酸的顺序分类,再根据盐的水解和弱电解质的电离特点比较pH;
(2)CH3COONa的水解平衡常数Kh=$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=$\frac{c(CHCOOH)•c({H}^{+})•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}$=$\frac{Kw}{Ka}$;
(3)pH=3的醋酸和pH=11的氢氧化钠溶液中,醋酸浓度大于氢氧化钠,二者等体积混合,醋酸过量,溶液中存在物料守恒和电荷守恒;
(4)醋酸钠是强碱弱酸盐,其溶液呈碱性,要使醋酸和氢氧化钠混合溶液呈中性,则醋酸应该稍微过量,溶液中存在物料守恒.
解答 解:(1)盐酸和醋酸为酸,氢氧化钡为碱,碳酸钠、氯化钾和氯化铵为盐,碳酸钠为强碱弱酸盐,其溶液呈碱性,氯化钾为强酸强碱盐,为中性,氯化铵为强酸弱碱盐,其溶液为酸性,相同浓度的盐酸和醋酸,醋酸中氢离子浓度小于盐酸,所以pH盐酸小于醋酸,则这几种溶液的pH由小到大的顺序是①②⑥⑤④③,
故答案为:①②⑥⑤④③;
(2)CH3COONa的水解平衡常数Kh=$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=$\frac{c(CHCOOH)•c({H}^{+})•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}$=$\frac{Kw}{Ka}$=$\frac{1{0}^{-14}}{1.7×1{0}^{-5}}$=5.9×10-10,故答案为:5.9×10-10;
(3)pH=3的醋酸和pH=11的氢氧化钠溶液中,醋酸浓度大于氢氧化钠,二者等体积混合,醋酸过量,导致混合溶液呈酸性,溶液中存在物料守恒和电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),
故答案为:酸性;c(Na+)+c(H+)=c(CH3COO-)+c(OH-);
(4)醋酸钠是强碱弱酸盐,其溶液呈碱性,要使醋酸和氢氧化钠混合溶液呈中性,则醋酸应该稍微过量,所以m>n,二者混合时溶液体积增大一倍,溶液中存在物料守恒,根据物料守恒得c(CH3COO-)+c(CH3COOH)=0.5mmol/L,
故答案为:0.5mmol/L;>.
点评 本题考查了弱电解质的电离,涉及pH大小的判断、酸碱混合溶液定性判断等知识点,明确物质的性质及弱电解质电离特点是解本题关键,难点是(2),会根据微粒间的关系进行公式转换,难度较大.

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案(1)电解精炼铜后所得的阳极泥的综合利用:
①用稀硝酸处理阳极泥得到硝酸银稀溶液,写出该步反应的离子方程式:3Ag+4H++NO3-=3Ag++NO↑+2H2O
②残渣含有极少量的黄金.经过查阅有关资料,了解到一些有关金的知识如下:
| 序号 | 反应 | 化学平衡常数 |
| 1 | Au+6HNO3(浓)?Au(NO3)3+3NO2↑+3H2O | <<1 |
| 2 | Au3++4Cl-=AuCl4- | >>1 |
(2)电解后废液的测定:以下是该小组探究废液的一个实验流程:

①锌同铝一样,都是活泼金属,其氢氧化物既能溶于强酸生成Zn2+,又能溶于强碱生成ZnO22-.写出锌和氢氧化钠溶液反应的离子方程式Zn+2OH-+2H2O=[Zn(OH)4]2-+H2↑
②100mL废液中Cu2+的浓度为0.5mol•L-1,Fe2+的浓度为0.1mol•L-1.
| A. | 18s | B. | 12s | C. | 30s | D. | 10s |
| A. | CH2Br-CH2Br 二溴乙烷 | B. | CH3OOCCH3甲酸乙酯 | ||
| C. | 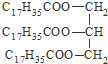 硬脂酸甘油脂 硬脂酸甘油脂 | D. | 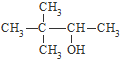 3,3-二甲基-2-丁醇 3,3-二甲基-2-丁醇 |
| A. | 它们都属于混合物 | B. | 它们都是乙烯的同系物 | ||
| C. | 它们的分子都不含氢原子 | D. | 聚四氟乙烯分子中含有双键 |
| A. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 一小块钠投入水中:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 用氢氧化钠溶液吸收过量二氧化碳 OH-+CO2═HCO3- | |
| D. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| A. | 电解铝时阴极材料需要定期更换 | |
| B. | 炼钢中添加硅、锰、铝等作为脱氧剂,调整钢水的成分,制成多种性能优良的钢材 | |
| C. | 炼钢主要目的是在高温下用还原剂将过多的碳和其他杂质还原成气体或炉渣除去 | |
| D. | 工业上一般以铁矿石、焦炭、石灰石和空气等原料在高炉中冶炼生铁 |
| A. | 溶液中Na+浓度增大,有H2放出 | |
| B. | 溶液中Na+数目减少,有H2放出 | |
| C. | 溶液中Na+与OH-浓度都增大,有H2放出 | |
| D. | 溶液中OH-数目增大,有H2放出 |