题目内容
16. 回答下列问题:
回答下列问题:(1)“霾”是当今世界环境热点话题.目前宁夏境内空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g)△H=-a kJ•mol-1(a>0)
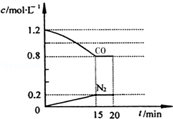
在一定温度下,将2.0mol NO、2.4mol CO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示:
①0~15min N2的平均速率v(N2)=0.013mol/(L•min);NO的转化率为40%.
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是CD(选填序号).
A.缩小容器体积 B.增加CO的量
C.降低温度 D.扩大容器体积
③其它条件不变,按以下选项充入起始物质,各物质体积分数仍然不变的是CD.
A.4.0mol NO、4.8mol CO
B.1.0mol NO、1.2mol CO、1.0mol CO2、0.5mol N2
C.1.6mol NO、2.0mol CO、0.4mol CO2、0.2mol N2
D.0.4mol CO、2.0mol CO2、1mol N2
(2)实验室配制FeCl3溶液时,将FeCl3固体溶解在稀盐酸中,请结合离子方程式用平衡移动原理解释原因氯化铁溶液中存在如下平衡:Fe3++3H2O?Fe(OH)3+3H+,增大H+浓度,平衡逆向移动,抑制FeCl3水解.
(3)“氯胺(NH2Cl)消毒法”是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2+NH3═NH2Cl+HCl.NH2Cl能与水反应生成可以杀菌消毒的物质(元素化合价不变).
①NH2Cl与水反应的化学方程式是NH2Cl+H2O=HClO+NH3.
②在Cl2+NH3═NH2Cl+HCl中,每消耗0.5mol Cl2,转移电子0.5mol mol.
分析 (1)①根据v=$\frac{△c}{△t}$计算v(N2),根据n=△c×V计算生成N2的物质的量,根据方程式计算参加反应NO物质的量,进而计算NO的转化率;
②A.缩小容器体积,压强增大,平衡向正反应方向移动,移动结果不能消除CO浓度增大;
B.增加CO的量,CO的浓度增大;
C.降低温度,平衡向正反应方向移动;
D.扩大容器体积,压强减小,平衡向逆反应方向移动,平衡时CO浓度减小;
③改变起始投料量平衡时各物质体积分数仍然不变,说明与原平衡为等效平衡,正反应为气体体积减小的反应,恒温恒容下按化学计量数转化到方程式左边满足同种物质投料量相等,即满足n(NO)=2.0mol、n(CO)=2.4mol;
(2)Fe3+在溶液中水解显酸性,通过增大H+浓度的方式抑制Fe3+水解;
(3)①根据题目信息“生成可以杀菌消毒的物质”可知一种产物为HClO,根据守恒的原则,另一种产物为NH3;
②只有Cl元素化合价发生变化,根据氯气物质的量计算HCl物质的量,结合Cl元素化合价变化计算转移电子.
解答 解:(1)①由图可知,15min N2的浓度变化量为0.2mol/L,则v(N2)=$\frac{0.2mol/L}{15min}$≈0.013mol/(L•min),生成氮气为2L×0.2mol/L=0.4mol,则参加反应的NO为2×0.4mol=0.8mol,故NO的转化率为:$\frac{0.8mol}{2mol}$×100%=40%,
故答案为:0.013mol/(L•min);40%;
②A缩小容器体积,压强增大,平衡向正反应方向移动,移动结果不能消除CO浓度增大,平衡时CO浓度增大,故A错误;
B.增加CO的量,CO的浓度增大,故B错误;
C.降低温度,平衡向正反应方向移动,CO浓度减小,故C正确;
D.扩大容器体积,压强减小,平衡向逆反应方向移动,但平衡时CO浓度减小,故D正确;
故答案为:CD;
③A.与原平衡相比压强增大,平衡正向移动,转化率增大,平衡时各物质的体积分数发生变化,故A错误;
B.等效为起始投入2molNO、2.2molCO,与原平衡不是等效平衡,故B错误;
C.转化到方程式左边可以得到2molNO、2.4molCO,与原平衡为等效平衡,故C正确;
D.0.4mol CO、2.0mol CO2、1mol N2相当于n(NO)=2.0mol、n(CO)=2.4mol,与原平衡互为等效平衡,故D正确;
故答案为:CD;
(2)因为Fe3+存在水解平衡:Fe3++3H2O?Fe(OH)3+3H+,水解后溶液显酸性,所以通过增大H+浓度的方式抑制Fe3+水解,
故答案为:氯化铁溶液中存在如下平衡:Fe3++3H2O?Fe(OH)3+3H+,增大H+浓度,平衡逆向移动,抑制FeCl3水解;
(3)①根据题目信息“生成可以杀菌消毒的物质”可知一种产物为HClO,根据守恒的原则,另一种产物为NH3,方程式为:NH2Cl+H2O=HClO+NH3,
故答案为:NH2Cl+H2O=HClO+NH3;
②只有Cl元素化合价发生变化,化合价分别由0价变化为-1价、+1价,消耗氯气的物质的量为0.5mol,生成HCl为0.5mol,则转移电子0.5mol,
故答案为:0.5.
点评 本题考查较为综合,涉及化学平衡计算与影响因素、化学反应速率的计算、等效平衡、盐类水解、氧化还原反应等知识,是对学生综合能力的考查,题目难度中等,注意熟练掌握化学平衡及其影响,试题充分考查了学生的分析能力及灵活应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | v(A)=0.7mol•L-1•min-1 | B. | v (B)=0.3mol•L-1•min-1 | ||
| C. | v (C)=0.9mol•L-1•min-1 | D. | v (D)=0.8mol•L-1•s-1 |
| 化学式 | H2(g) | CO(g) | CH3OH(l) |
| 标准燃烧热(25℃) △H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |
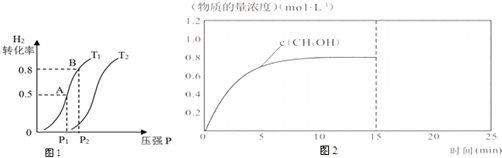
(2)在容积可变的密闭容器中充入1molCO(g)和2molH2(g)进行CO(g)+2H2(g)?CH3OH(g)生
成CH3OH(g),H2的平衡转化率随温度(T)、压强(P)的变化如图1所示.
①该反应的△S<0,图中的T1<T2(填“<”、“>”或“=”).
②当达到平衡状态A 时,容器的体积为2L,此时该反应的平衡常数为4,若达到平衡状态B 时,则容器的体积V(B)=0.4 L.
③在该容器中,下列措施可增加甲醇产率的是B.
A.升高温度 B.从平衡体系中及时分离CH3OH C.充入He D.再充入0.5mol CO和1mol H2
(3)在容积固定为2L的密闭容器中充入2molCO(g)和6molH2(g)生成CH3OH(g)反应时间与物质的量浓度的关系如图2所示,则前10分钟内,氢气的平均反应速率0.16mol/(L•min);若15分钟时升高体系温度,在20分钟时达到新平衡,此时氢气的转化率为33.3%,请在图2中画出15-25分钟c (CO)的变化曲线.
(一)制备苯乙烯(原理如反应I所示):
I.
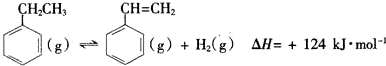
(1)部分化学键的键能如表所示:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | x | 436 |
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气.用化学平衡理论解释通入水蒸气的原因为该反应正向为气体分子数增大的反应,入水蒸气需增大容器容积,减小体系压强,平衡正向移动,增大反应物的转化率.
(3)从体系自由能变化的角度分析,反应I在高温(填“高温”或“低温”)下有利于其自发进行.
(二)制备α-氯乙基苯(原理如反应II所示):
II.
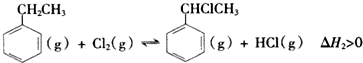
(4)T℃时,向10L恒容密闭容器中充人2mol乙苯(g)和2mol Cl2(g)发生反应Ⅱ,5min时达到平衡,乙苯和Cl2、α-氯乙基苯和HCl的物质的量浓度(c)随时间(t)变化的曲线如图l所示:
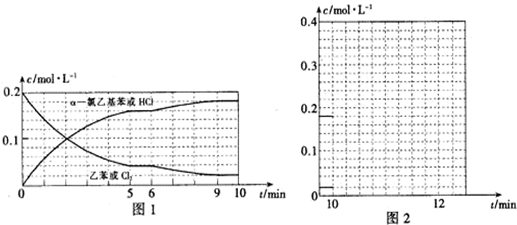
①0-5min内,以HCl表示的该反应速率v(HCl)=0.032 mol•L-1•min-1.
②T℃时,该反应的平衡常数K=16.
③6min时,改变的外界条件为升高温度.
④10min时,保持其他条件不变,再向容器中充人1moI乙苯、1mol Cl2、1mol α-氯乙基苯和l mol HCl,12min时达到新平衡.在图2中画出10-12min,Cl2和HCl的浓度变化曲线(曲线上标明Cl2和HC1);0-5min和0-12min时间段,Cl2的转化率分别用α1、α2表示,则αl<α2(填“>”、“<”或“=”).
| A. | 为防止电池中的重金属污染土壤和水体,应积极开发废旧电池的综合回收利用 | |
| B. | 氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念 | |
| C. | 大量的汽车尾气是造成雾霾天气的一个重要因素 | |
| D. | 煤的液化和气化均属于化学变化 |
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内用O2表示的平均速率为1.48×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | |
| C. | T1温度下N2O5的平衡转化率为50% | |
| D. | 平衡后其它条件不变,将容器的体积压缩到原来的一半,则再平衡时c(N2O5)>5.00mol/L |