题目内容
下列离子方程式书写正确的是( )
| A、澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-→CaCO3↓+H2O |
| B、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O→2Al(OH)3↓+CO32- |
| C、向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全:H++SO42-+Ba2++OH-→BaSO4↓+H2O |
| D、向含有0.1 mol溶质的FeI2溶液中通入0.1 mol的Cl2:2Fe+2I-+2Cl2→2Fe3++I2+4Cl- |
考点:离子方程式的书写
专题:离子反应专题
分析:A、酸式盐和碱反应,量少的全部反应,离子方程式中符合化学式的组成比;
B、过量二氧化碳反应生成碳酸氢钠;
C、向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全,NaHSO4和Ba(OH)2至按照1:1反应;
D、FeI2溶液中I-还原性大于Fe2+,通入氯气顺序进行反应.
B、过量二氧化碳反应生成碳酸氢钠;
C、向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全,NaHSO4和Ba(OH)2至按照1:1反应;
D、FeI2溶液中I-还原性大于Fe2+,通入氯气顺序进行反应.
解答:
解:A、酸式盐和碱反应量少的全部反应,离子方程式中符合化学式的组成比,澄清石灰水与过量的小苏打溶液反应的离子方程式为Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-,故A错误;
B、过量二氧化碳反应生成碳酸氢钠,向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故B错误;
C、向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全,NaHSO4和Ba(OH)2至按照1:1反应,H++SO42-+Ba2++OH-=BaSO4↓+H2O,故C正确;
D、FeI2溶液中I-还原性大于Fe2+,通入氯气顺序进行反应,向含有0.1 mol溶质的FeI2溶液中通入0.1 mol的Cl2:2I-+Cl2=I2+2Cl-,故D错误;
故选C.
B、过量二氧化碳反应生成碳酸氢钠,向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故B错误;
C、向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全,NaHSO4和Ba(OH)2至按照1:1反应,H++SO42-+Ba2++OH-=BaSO4↓+H2O,故C正确;
D、FeI2溶液中I-还原性大于Fe2+,通入氯气顺序进行反应,向含有0.1 mol溶质的FeI2溶液中通入0.1 mol的Cl2:2I-+Cl2=I2+2Cl-,故D错误;
故选C.
点评:本题考查了离子方程式书写方法和注意问题,主要是量不同产物不同的分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列反应能设计成原电池提供电能的是( )
| A、Cu与Cl2燃烧反应 |
| B、Ba(OH)2?8H2O与NH4Cl反应 |
| C、灼热的炭与CO2反应 |
| D、氢氧化钠溶液与稀盐酸反应 |
向硫酸铝铵溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是( )
| A、NH4++SO42-+Ba2++OH-→BaSO4↓+NH3?H2O |
| B、2Al3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Al(OH)3↓ |
| C、Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+AlO2-+2H2O |
| D、NH4++Al3++2SO42-+2Ba2++4OH-→2BaSO4↓+Al(OH)3↓+NH3?H2O |
下列各组中的两种物质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是( )
①碳酸钠溶液与盐酸 ②偏铝酸钠溶液与盐酸 ③二氧化碳与氢氧化钠溶液
④硝酸银溶液和氨水 ⑤氯化铝与氨水 ⑥碳酸氢钠溶液与澄清石灰水.
①碳酸钠溶液与盐酸 ②偏铝酸钠溶液与盐酸 ③二氧化碳与氢氧化钠溶液
④硝酸银溶液和氨水 ⑤氯化铝与氨水 ⑥碳酸氢钠溶液与澄清石灰水.
| A、③⑤ | B、①③⑥ |
| C、仅有⑤ | D、②④ |
“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用.如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出).下列有关该方法的叙述中不正确的是( )
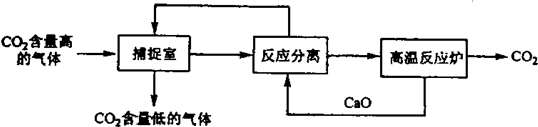

| A、能耗大是该方法的一大缺点 |
| B、整个过程中,既有氧化还原反应又有非氧化还原反应 |
| C、“反应分离”环节中,分离的基本操作是过滤 |
| D、整个过程中,有2种物质可以循环利用 |
