题目内容
下表为元素周期表的一部分,表中列出了11种元素在周期表中的位置,按要求完成下列各小题.
(1)化学性质最不活泼的元素是 (填元素符号),其原子结构示意图为 .
(2)元素⑧的名称为,其最高价氧化物的水化物的化学式为 .
(3)元素③与元素⑧形成化合物的电子式为 .
(4)非金属性最强的元素是 (填元素符号).除0族外原子半径最大的元素是 (填元素符号).元素①单质与水反应的离子方程式是 .
(4)①、③、⑤三种元素的最高价氧化物水化物中,碱性最强的化合物的化学式是 .
(5)能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与①的最高价氧化物的水化物反应的化学方程式 .
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ⑨ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ |
(2)元素⑧的名称为,其最高价氧化物的水化物的化学式为
(3)元素③与元素⑧形成化合物的电子式为
(4)非金属性最强的元素是
(4)①、③、⑤三种元素的最高价氧化物水化物中,碱性最强的化合物的化学式是
(5)能形成两性氢氧化物的元素是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素周期表可知,①为Na,②为K,③为Mg,④为Ca,⑤为Al,⑥为C,⑦为O,⑧为Cl,⑨为F,⑩为Ar,利用元素的单质的性质及金属性越强、对应的最高价氧化物的水化物的碱性越强,比较半径先看层,具有相同排布的离子半径越小的其原子序数越大,以此来解答.
解答:
解:由元素周期表可知,①为Na,②为K,③为Mg,④为Ca,⑤为Al,⑥为C,⑦为O,⑧为Cl,⑨为Br,⑩为Ar,
(1)以上元素中,只有Ar的最外层电子数为8,为稳定结构,则化学性质最不活泼,其原子结构示意图为 ,故答案为:Ar;
,故答案为:Ar; ;
;
(2)元素⑧的名称为氯元素,其最高价氧化物的水化物的化学式为HClO4,故答案为:氯;HClO4;
(3)元素③与元素⑧形成化合物是氯化镁,其电子式为 ,故答案为:
,故答案为: ;
;
(4)非金属性最强的在元素周期表的右上角,元素是F;除0族外原子半径最大在元素周期表的左下角,元素是K;元素钠单质与水反应的离子方程式是2Na+2H2O=2Na++2OH-+H2↑,故答案为:F;K;2Na+2H2O=2Na++2OH-+H2↑;
(4)Na、Mg、Al三种元素的最高价氧化物水化物中,碱性最强,就是中心元素的金属性最强,同周期从左到右金属性减弱,该化合物的化学式是NaOH,故答案为:NaOH;
(5)能形成两性氢氧化物的元素是Al,铝与氢氧化钠反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:Al;2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(1)以上元素中,只有Ar的最外层电子数为8,为稳定结构,则化学性质最不活泼,其原子结构示意图为
 ,故答案为:Ar;
,故答案为:Ar; ;
;(2)元素⑧的名称为氯元素,其最高价氧化物的水化物的化学式为HClO4,故答案为:氯;HClO4;
(3)元素③与元素⑧形成化合物是氯化镁,其电子式为
 ,故答案为:
,故答案为: ;
;(4)非金属性最强的在元素周期表的右上角,元素是F;除0族外原子半径最大在元素周期表的左下角,元素是K;元素钠单质与水反应的离子方程式是2Na+2H2O=2Na++2OH-+H2↑,故答案为:F;K;2Na+2H2O=2Na++2OH-+H2↑;
(4)Na、Mg、Al三种元素的最高价氧化物水化物中,碱性最强,就是中心元素的金属性最强,同周期从左到右金属性减弱,该化合物的化学式是NaOH,故答案为:NaOH;
(5)能形成两性氢氧化物的元素是Al,铝与氢氧化钠反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:Al;2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
点评:本题考查位置、结构、性质的关系,利用元素周期表得出各元素是解答本题的关键,然后利用元素的性质、同周期元素的性质变化规律、离子半径的比较规律来解答即可.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列离子方程式书写正确的是( )
| A、澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-→CaCO3↓+H2O |
| B、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O→2Al(OH)3↓+CO32- |
| C、向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全:H++SO42-+Ba2++OH-→BaSO4↓+H2O |
| D、向含有0.1 mol溶质的FeI2溶液中通入0.1 mol的Cl2:2Fe+2I-+2Cl2→2Fe3++I2+4Cl- |
下列各项表达中不正确的是( )
A、Cl-的结构示意图为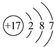 |
| B、D216O中,质量数之和是质子数之和的两倍 |
| C、在氮原子中,质子数为7而中子数不一定为7 |
| D、Be2+中的电子数和质子数之比一定为1:2 |

 A、B、C是三种短周期元素的单质,甲、乙是两种常见的化合物.这些单质和化合物之间存在如图所示关系.写出符合如图关系的A,B,C的化学式,(1)~(3)中的A不在同一主族.
A、B、C是三种短周期元素的单质,甲、乙是两种常见的化合物.这些单质和化合物之间存在如图所示关系.写出符合如图关系的A,B,C的化学式,(1)~(3)中的A不在同一主族.