题目内容
7.现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液.相应的实验过程可用下图表示: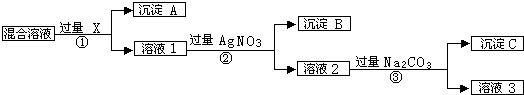
请回答下列问题:
(1)试剂X的电子式
 ,沉淀A的晶体类型离子晶体,CO32-的空间构型是平面三角形.
,沉淀A的晶体类型离子晶体,CO32-的空间构型是平面三角形.(2)上述实验流程中加入过量的Na2CO3的目的是除去过量的Ba(NO3)2〔或BaCl2〕和AgNO3.发生反应的离子方程式是:Ba2++CO32-=BaCO3↓、2Ag++CO32-=Ag2CO3↓.
(3)按此实验方案得到的溶液3中肯定含有Na2CO3(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的HNO3,之后若要获得固体NaNO3需进行的实验操作是蒸发、过滤(填操作名称).
分析 如先加入AgNO3,则会同时生成Ag2SO4和AgCl沉淀,则应先加入过量的BaCl2[或Ba(NO3)2],生成BaSO4沉淀,然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3,最后进行蒸发操作可得固体NaNO3,以此解答该题.
解答 解:如先加入AgNO3,则会同时生成Ag2SO4和AgCl沉淀,则应先加入过量的BaCl2[或Ba(NO3)2],生成BaSO4沉淀,然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,则试剂X为BaCl2[或Ba(NO3)2],沉淀A为BaSO4,沉淀B为AgCl,
(1)由上述分析可知X为BaCl2,其电子式为 ,沉淀A为BaSO4,为离子晶体,CO32-中孤对电子$\frac{4+2-3×2}{2}$=0,价层电子对个数=3+0=3,则C采取sp2杂化,空间构型为平面三角形;
,沉淀A为BaSO4,为离子晶体,CO32-中孤对电子$\frac{4+2-3×2}{2}$=0,价层电子对个数=3+0=3,则C采取sp2杂化,空间构型为平面三角形;
故答案为: ;离子;平面三角形;
;离子;平面三角形;
(2)加入过量的BaCl2[或Ba(NO3)2],然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,在所得滤液中含有Ag+、Ba2+,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,发生的离子反应为Ba2++CO32-=BaCO3↓、2Ag++CO32-=Ag2CO3↓,
故答案为:除去过量的Ba(NO3)2〔或BaCl2〕和AgNO3;Ba2++CO32-=BaCO3↓、2Ag++CO32-=Ag2CO3↓;
(3)溶液3为NaNO3和Na2CO3的混合物,加入稀HNO3,可除去Na2CO3,之后蒸发、过滤得到硝酸钠,
故答案为:Na2CO3;HNO3;蒸发、过滤.
点评 本题考查混合物的分离提纯的综合应用,为高频考点,把握流程中的反应及混合物分离方法等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

| A. | 100ml 18.4mol/L的硫酸溶液中含氢离子的数目为3.68NA | |
| B. | 若x g 中含NA个分子,则2x g中含2NA个分子 | |
| C. | 常温常压下,92gNO2和N2O4的混合气体含有的原子数为6NA | |
| D. | 11g铵根离子[NH2T2]+中含中子数为4.5NA |
| A. | V=336 mL时,c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| B. | V=448 mL时,2c(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)] | |
| C. | V=672 mL时,c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) | |
| D. | 通入CO2过程中恒有关系式:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| A. | N4是一种新型化合物 | B. | N4和N2互为同素异形体 | ||
| C. | N4分子和N2一样含有N≡N | D. | N4中含极性共价键 |
| A. | 3:2:1 | B. | 1:1:1 | C. | 1:2:3 | D. | 6:3:2 |
| A. | CS2为直线形的非极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中有6对完全相同的成键电子对 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化 |
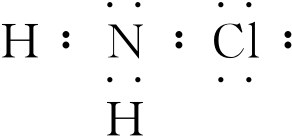 ,H2NCl中氯的化合价为+1价.
,H2NCl中氯的化合价为+1价.