题目内容
18.X(g)+3Y(g)?2Z(g)△H=-a kJ•mol-1,一定条件下,将1mol X和3mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4mol.X的平均反应速率是( )| A. | 0.03 mol•L-1•s-1 | B. | 0.03 mol•L-1•min-1 | ||
| C. | 0.01 mol•L-1•s-1 | D. | 0.01 mol•L-1•min-1 |
分析 先根据v=$\frac{△c}{△t}$=$\frac{\frac{△n}{V}}{△t}$计算出用Y表示的平均反应速率,然后根据化学反应速率与化学计量数成正比计算出X的平均反应速率.
解答 解:反应10min,Y的物质的量变化为:3mol-2.4mol=0.6mol,
则用Y表示的平均反应速率为:v(Y)=$\frac{\frac{0.6mol}{2L}}{10min}$=0.03mol•L-1•min-1,
化学反应速率与化学计量数成正比,则v(X)=$\frac{1}{3}$v(Y)=0.01mol•L-1•min-1,
故选D.
点评 本题考查了化学反应速率的计算,题目难度不大,明确化学反应速率与化学计量数的关系为解答关键,注意掌握化学反应速率的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8. 央视曝光了双汇在食品生产中使用“瘦肉精”,一时间,市场哗然.瘦肉精的结构简式如图,下列有关说法错误的是( )
央视曝光了双汇在食品生产中使用“瘦肉精”,一时间,市场哗然.瘦肉精的结构简式如图,下列有关说法错误的是( )
 央视曝光了双汇在食品生产中使用“瘦肉精”,一时间,市场哗然.瘦肉精的结构简式如图,下列有关说法错误的是( )
央视曝光了双汇在食品生产中使用“瘦肉精”,一时间,市场哗然.瘦肉精的结构简式如图,下列有关说法错误的是( )| A. | 该有机物的核磁共振氢谱图中有6个吸收峰 | |
| B. | 该有机物的分子式为C12H18N2Cl2O | |
| C. | 该有机物能溶于水,且水溶液显碱性 | |
| D. | 该有机物能发生加成反应、取代反应、氧化反应和酯化反应 |
13.下列说法不正确的是( )
| A. | 氯气可用于自来水的消毒 | B. | 二氧化硫可以用来漂白食品 | ||
| C. | 氢氧化铁胶体能用于净水 | D. | 镁可用于制造信号弹和焰火 |
10.下列表示正确的是( )
| A. | 乙烯的球棍模型: | B. | 镁的原子结构示意图: | ||
| C. | 氯化钠的电子式: | D. | 乙炔的结构简式:CHCH |
8.将X溶液逐滴滴入Y溶液中,与将Y溶液逐滴滴入X溶液中,所产生的现象不同,则X,Y是表中的( )
| A | B | C | D | |
| X | BaCl2 | HCl | NaOH | NaCl |
| Y | H2SO4 | NaAlO2 | AlCl3 | AgNO3 |
| A. | A | B. | B | C. | C | D. | D |
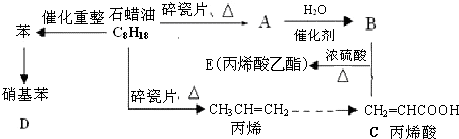
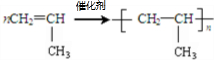 ;反应类型加聚反应.
;反应类型加聚反应.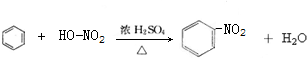 ;反应类型取代反应.
;反应类型取代反应.