题目内容
9.根据元素周期律,同周期元素从左到右金属性逐渐减弱,非金属性逐渐增强(填“增强”或“减弱”);现有S、Cl、Na等元素,这些元素中原子半径最大的是Na;S元素的最高价氧化物对应的水化物的化学式为H2SO4;元素氢化物的稳定性Cl大于S(填“大于”或“小于”).分析 同周期从左向右金属性减弱、非金属性增强、原子半径减小;非金属性越强,对应氢化物越稳定,S元素的最高价氧化物对应的水化物为硫酸,以此来解答.
解答 解:根据元素周期律,同周期元素从左到右金属性逐渐减弱,非金属性逐渐增强,现有S、Cl、Na等元素,这些元素中原子半径最大的是Na,S元素的最高价氧化物对应的水化物的化学式为H2SO4,元素氢化物的稳定性Cl大于S,
故答案为:减弱;增强;Na;H2SO4;大于.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
4.下列元素中,最高正化合价数值最大的是( )
| A. | C | B. | Al | C. | S | D. | Ne |
14.下列氧化物是硝酸的酸酐的是( )
| A. | N2O5 | B. | NO2 | C. | NO | D. | N2O4 |
1.下列溶液中跟100mL 0.1mol/L 硫酸钾溶液里钾离子物质的量浓度相同的是( )
| A. | 100 mL 0.2 mol/L 氯化钾溶液 | B. | 200 mL 0.1 mol/L 硝酸钾溶液 | ||
| C. | 100 mL 0.1 mol/L 硝酸钾溶液 | D. | 50 mL 0.2 mol/L 磷酸钾溶液 |
18.X(g)+3Y(g)?2Z(g)△H=-a kJ•mol-1,一定条件下,将1mol X和3mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4mol.X的平均反应速率是( )
| A. | 0.03 mol•L-1•s-1 | B. | 0.03 mol•L-1•min-1 | ||
| C. | 0.01 mol•L-1•s-1 | D. | 0.01 mol•L-1•min-1 |
19.如图为元素周期表短周期中的一部分,有关元素X、Y、Z、M的说法错误的是( )
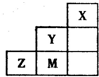

| A. | Y、Z可形成ZY6分子 | B. | X晶体属于原子晶体 | ||
| C. | 原子半径:Z>M>Y | D. | Z离子的结构示意图可表示为: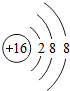 |


 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O
+2H2O 
 B.
B.
