题目内容
2.下列说法不正确的是( )| A. | 使用滴定管前要检查是否漏液 | |
| B. | 用简易量热计测定反应热时,用环形玻璃搅拌棒进行搅拌使酸和碱充分反应,以达到良好的实验效果 | |
| C. | 用精密pH试纸测得某浓度氯水的pH为3.5 | |
| D. | 燃料电池实验中,用KNO3溶液或Na2SO4溶液代替蒸馏水,效果要好得多 |
分析 A、根据带有旋塞和瓶塞的仪器,一般在使用前需要检查是否漏水;
B.中和热的测定中,用环形玻璃棒搅拌,使反应充分进行,可减小误差;
C.pH试纸测得溶液的PH值为整数;
D.增强溶液的导电性.
解答 解:A、滴定管是带有旋塞的仪器,使用前需要检查是否漏水,故A正确;
B.用简易量热计测定反应热时,为了减小误差,需用环形玻璃搅拌棒搅拌使酸和碱充分反应,故B正确;
C.pH试纸测得溶液的PH值为整数,不可能为小数,所以测不到pH为3.5,故C错误;
D.用KNO3溶液或Na2SO4溶液代替蒸馏水,增强溶液的导电性,所以效果水,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及pH测定、电解质、中和热的测定等,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
12.分类法是重要的科学研究方法,下列物质归类正确的是( )
| A. | 碱:苛性钠、纯碱、熟石灰 | |
| B. | 盐:胆矾、小苏打、铜绿 | |
| C. | 碱性氧化物:氧化铜、七氧化二锰、氧化铝 | |
| D. | 无丁达尔现象的分散系:碘的四氧化碳溶液、淀粉溶液、氯化铁溶液 |
13.某体积可变的密闭容器,盛有适量的A、B混合气体,在一定条件下发生反应A(g)+3B(g)?2C(g).若维持温度和压强不变,当反应达到限度时容器的体积为VL,其中C气体的体积分数占10%.下列推断正确的是( )
| A. | 原混合气体的体积为1.1VL | |
| B. | 原混合气体的体积为1.2VL | |
| C. | 反应达到限度时,气体A消耗掉0.05 VL | |
| D. | 反应达到限度时,气体B消耗掉0.05 VL |
10.在水中放入高锰酸钾晶体后,可以清楚地看到,溶液中紫红色范围逐渐扩大,最后整个溶液都变成紫红色,原因是( )
| A. | 钾离子受到水分子的作用,克服了离子间的引力,逐渐向水中扩散 | |
| B. | 高锰酸根离子受到钾离子的作用,克服了离子间的斥力,逐渐向水中扩散 | |
| C. | 高锰酸根离子受到水分子的作用,克服了离子间的引力,逐渐向水中扩散 | |
| D. | 高锰酸钾是强氧化剂,水被氧化 |
17.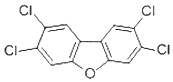 香港食环署食物安全中心日前宣布,两个大闸蟹养殖场样本,被验出二噁英样多氯联苯含量超标.2,4,7,8-四氯二苯并呋喃是其中的一种,结构简式如图,下列有关该物质的说法正确的是( )
香港食环署食物安全中心日前宣布,两个大闸蟹养殖场样本,被验出二噁英样多氯联苯含量超标.2,4,7,8-四氯二苯并呋喃是其中的一种,结构简式如图,下列有关该物质的说法正确的是( )
 香港食环署食物安全中心日前宣布,两个大闸蟹养殖场样本,被验出二噁英样多氯联苯含量超标.2,4,7,8-四氯二苯并呋喃是其中的一种,结构简式如图,下列有关该物质的说法正确的是( )
香港食环署食物安全中心日前宣布,两个大闸蟹养殖场样本,被验出二噁英样多氯联苯含量超标.2,4,7,8-四氯二苯并呋喃是其中的一种,结构简式如图,下列有关该物质的说法正确的是( )| A. | 能发生氧化反应 | B. | 一溴取代物只有一种 | ||
| C. | 属于氯代芳香烃 | D. | 易溶于水 |
7.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 反应可表示为X+3Y?2Z | |
| C. | 改变温度可以改变此反应的平衡常数 | |
| D. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 |
14. 某研究性学习小组设计不同实验方案来研究硝酸的性质.
某研究性学习小组设计不同实验方案来研究硝酸的性质.
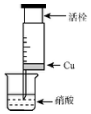
(1)甲组同学设计如图装置来证实稀稍酸与铜反应,步骤如下.
A.检验50ml针筒的气密性.
B.抽出活栓,往针筒内放入一小块铜片,把针筒活栓推到底,将针筒下端玻璃管浸入蒸馏水中,抽拉活栓,吸入约10mL蒸馏水,发现针筒内仍有空气,然后针头朝上倒放,推活栓,使针头内充满水.
C.将针筒下端玻璃管浸入浓硝酸中,抽拉活栓,缓缓吸入4mL浓硝酸,将针筒下端套上橡皮管,然后用铁夹夹住.
回答以下相关问题:
①一段时间后在针筒内观察到溶液颜色为蓝色,有无色气体产生.该反应的化学方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.
②反应停止后,针筒内产生了气体,要验证产生的气体是NO,还需进一步进行的操作是往针筒内抽气,气体由无色变红棕色.
(2)乙组同学也用此装置直接抽取浓硝酸和铜反应,发现溶液是绿色的,为了探究绿色的原因,乙组同学又做了三组对比实验,具体如表:
根据乙组同学三组对比实验回答问题:
①一种观点认为:这可能是Cu2+浓度差异的结果,你同意这种看法吗?不同意(填“同意”或“不同意”),原因是相同质量的铜与相同体积且过量的硝酸反应生成的铜离子浓度相同.结合表格信息加以阐述)
②另一种观点认为:溶液呈绿色是铜与浓硝酸反应时产生的NO2溶于过量浓硝酸显黄色,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色.为了验证推断是否正确,三位同学分别设计了三种方案,并进行验证:
方案一:将绿色溶液转移至试管,并给试管加热片刻,立即看到大量红棕色气体产生.认为该气体一定是溶解在溶液中的NO2,但也有同学持有异议.请分析原因过量的硝酸分解会产生红棕色的NO2.
方案二:用双氧水和二氧化锰制得氧气,并把氧气缓缓通入绿色溶液中,观察溶液颜色变为蓝色.请用方程式表示溶液颜色变化的反应原理4NO2+O2+2H2O=4HNO3.
方案三:往蓝色溶液中缓缓通入NO2气体,溶液颜色变绿色.
③从环保的角度看,你认为三个方案中最好的是哪一个方案二.
 某研究性学习小组设计不同实验方案来研究硝酸的性质.
某研究性学习小组设计不同实验方案来研究硝酸的性质.(1)甲组同学设计如图装置来证实稀稍酸与铜反应,步骤如下.
A.检验50ml针筒的气密性.
B.抽出活栓,往针筒内放入一小块铜片,把针筒活栓推到底,将针筒下端玻璃管浸入蒸馏水中,抽拉活栓,吸入约10mL蒸馏水,发现针筒内仍有空气,然后针头朝上倒放,推活栓,使针头内充满水.
C.将针筒下端玻璃管浸入浓硝酸中,抽拉活栓,缓缓吸入4mL浓硝酸,将针筒下端套上橡皮管,然后用铁夹夹住.
回答以下相关问题:
①一段时间后在针筒内观察到溶液颜色为蓝色,有无色气体产生.该反应的化学方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.
②反应停止后,针筒内产生了气体,要验证产生的气体是NO,还需进一步进行的操作是往针筒内抽气,气体由无色变红棕色.
(2)乙组同学也用此装置直接抽取浓硝酸和铜反应,发现溶液是绿色的,为了探究绿色的原因,乙组同学又做了三组对比实验,具体如表:
| 组 | m(Cu)/g | 硝酸(过量) | 溶液颜色 |
| A | 1 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| B | 0.5 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| C | 2 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 |
①一种观点认为:这可能是Cu2+浓度差异的结果,你同意这种看法吗?不同意(填“同意”或“不同意”),原因是相同质量的铜与相同体积且过量的硝酸反应生成的铜离子浓度相同.结合表格信息加以阐述)
②另一种观点认为:溶液呈绿色是铜与浓硝酸反应时产生的NO2溶于过量浓硝酸显黄色,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色.为了验证推断是否正确,三位同学分别设计了三种方案,并进行验证:
方案一:将绿色溶液转移至试管,并给试管加热片刻,立即看到大量红棕色气体产生.认为该气体一定是溶解在溶液中的NO2,但也有同学持有异议.请分析原因过量的硝酸分解会产生红棕色的NO2.
方案二:用双氧水和二氧化锰制得氧气,并把氧气缓缓通入绿色溶液中,观察溶液颜色变为蓝色.请用方程式表示溶液颜色变化的反应原理4NO2+O2+2H2O=4HNO3.
方案三:往蓝色溶液中缓缓通入NO2气体,溶液颜色变绿色.
③从环保的角度看,你认为三个方案中最好的是哪一个方案二.
11.a、b、c是同周期的三种短周期元素.a的原子结构示意图为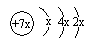 ,b与c形成的化合物的电子式为
,b与c形成的化合物的电子式为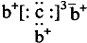 ,下列比较中正确的是( )
,下列比较中正确的是( )
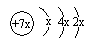 ,b与c形成的化合物的电子式为
,b与c形成的化合物的电子式为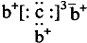 ,下列比较中正确的是( )
,下列比较中正确的是( )| A. | 原子半径:a>b>c | B. | 非金属性:a>c | ||
| C. | 氢化物的稳定性:c>a | D. | 最高价含氧酸的酸性:c>a |