题目内容
13.中学化学中常见的几种物质存在如图所示的转化关系.其中,A是一种黑色粉末状固体,C是一种黄绿色气体,实验室中常用E溶液吸收多余的C(图中部分产物和反应条件已略去).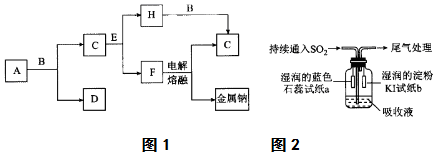
回答下列问题:
(1)写出A与B的浓溶液反应的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)将ag粉未A加入bmol/L的B的浓溶液cL中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,NA可表示为$\frac{87d}{2a}$.
(3)将B的浓溶液与H的浓溶液混合,立即产生大最气体C,该反应的离子方程式为ClO-+Cl-+2H+═Cl2↑+H2O.
(4)某课外小组的同学用E溶液吸收C,利用下图所示装置向吸收液中持续通入SO2气体.
实验过程中观察到如下现象:
①开始时,溶液上方出现白雾,试纸a变红.甲同学认为是HCl使a变红,乙同学不同意甲的观点,乙同学认为使a变红的是SO2(或H2SO3)(写出一种即可).
②片刻后,溶液上方出现黄绿色气体,试纸b变蓝.用离子方程式解释b变蓝的原因:Cl2+2I-=2Cl-+I2
③最终试纸b褪色.同学们认为可能的原因有两种:一是I2有还原性,黄绿色气体等物质将其氧化成IO3-,从而使蓝色消失;二是SO2有氧化性,能将I2还原成I-,从而使蓝色消失.
分析 A是一种黑色粉末状固体,C是一种黄绿色气体,则A为MnO2,B为浓盐酸,C为Cl2,常用E溶液吸收多余的C,则E为NaOH,H为NaClO,F为NaCl,氯气与二氧化硫发生氧化还原反应生成硫酸和HCl,则图2中溶液上方出现白雾,然后结合物质的性质及化学用语来解答.
解答 解:A是一种黑色粉末状固体,C是一种黄绿色气体,则A为MnO2,B为浓盐酸,C为Cl2,常用E溶液吸收多余的C,则E为NaOH,H为NaClO,F为NaCl,
(1)A与B的浓溶液反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)加热完全溶解,反应中转移电子d个,可知$\frac{ag}{87g/mol}$×(4-2)×NA=d,则NA=$\frac{87d}{2a}$,故答案为:$\frac{87d}{2a}$;
(3)B的浓溶液与H的浓溶液混合,立即产生大量气体C,该反应的离子方程式为ClO-+Cl-+2H+═Cl2↑+H2O,故答案为:ClO-+Cl-+2H+═Cl2↑+H2O;
(4)氯气与二氧化硫发生氧化还原反应生成硫酸和HCl,
①试纸a变红,说明有酸性物质存在,若二氧化硫过量,试纸a变红还可能与SO2(或H2SO3)有关,
故答案为:SO2(或H2SO3);
②上方出现黄绿色气体,试纸b变蓝,发生Cl2+2I-═2Cl-+I2,故答案为:Cl2+2I-═2Cl-+I2;
③最终试纸b褪色,可能与碘的还原性、氧化性有关,则可能的原因二为I2有氧化性,SO2能将I2还原成I-,从而使蓝色消失,故答案为:I2有氧化性,SO2能将I2还原成I-,从而使蓝色消失.
点评 本题考查无机物的推断,为高频考点,侧重氯气的实验室制备及氯、碘化合物之间转化的考查,把握物质的性质及框图中发生的反应为解答的关键,(4)中现象与反应的推断为解答的难点,题目难度中等.

| A. | “泥封”的目的是为了防止得到的锌被氧化 | |
| B. | “锌火”是锌蒸气和一氧化碳在空气的燃烧 | |
| C. | 冶炼时锌变为蒸气在兜室冷凝为固体 | |
| D. | 升炼倭铅过程包含分解反应和氧化还原反应 |
| A. | 用HR做导电实验,灯泡很暗 | |
| B. | 0.1mol•L-1HR溶液稀释到100倍时,溶液的pH值为3 | |
| C. | 20mL0.1mol•L-1HR恰好中和20mL0.1mol•L-1NaOH溶液 | |
| D. | 0.1mol•L-1NH4R溶液的pH等于7 |
| A. | 白酒 | B. | 石灰石 | C. | 冰水 | D. | 矿泉水 |
| A. | 天然的油脂大多数为混甘油酯 | |
| B. | 油脂在碱性条件下水解更彻底,工业应用该反应制肥皂 | |
| C. | 油脂分为液态的油和固体的脂肪 | |
| D. | 油脂没有不饱和双键,所以,油脂不能使高锰酸钾溶液反应 |
①质量相等;②密度相等;③所含分子个数相等;④所含碳原子个数相等.
| A. | ①②③④ | B. | ②③④ | C. | 只有③④ | D. | 只有④ |
①氢气能在氯气中燃烧产生黄色火焰,生成白烟
②铜丝在氯气中燃烧,生成蓝绿色的氯化铜
③液氯就是氯的水溶液,它能使干燥的有色布条褪色
④氯气能与氢氡化钙反应生成漂白粉,漂白粉的成分只有次氯酸钙
⑤自然界中存在大量氯的单质.
| A. | 只有①⑤ | B. | ①②③ | C. | 全部 | D. | ①④⑤ |
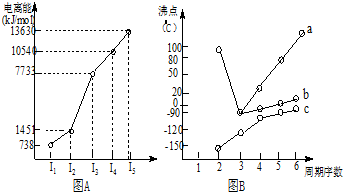
II.图B折线c可以表达出第IVA族元素氢化物的沸点的变化规律;两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线:a和b,你认为正确的是:b(填“a”或“b”).
已知部分有机物的熔沸点见下表:
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 | 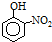 | 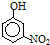 | 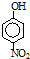 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
(2)COCl2俗称光气,分子中C原子采取sp2杂化成键;其中碳氧原子之间共价键含有c(填字母).
a.2个σ键 b.2个π键 c.1个σ键、1个π键
(3)金属是钛(Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布方式为3d24s2;
II.钢铁表面镀有下列金属时,当镀层部分被破坏时,铁不易被腐蚀的是b.(填字母)
a.Sn b.Zn c.Cu d.Pb.
| A. | 和过量的 NaOH 溶液充分反应并加热,可生成标准状况下的 NH3 4.48L | |
| B. | 通入 H2S 气体,发生反应的离子方程式为:H2S+Fe2+=FeS↓+2H+ | |
| C. | Ca2+、ClO-、Cl-、Cu2+能在该溶液中大量共存 | |
| D. | Cl-、H+、I-、Na+不能在该溶液中大量共存 |