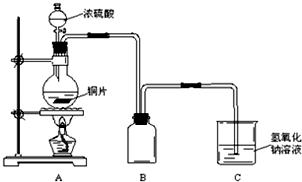
��Ŀ����
11����֪����N2��g��+3H2��g���T2NH3��g����H=-92.4kJ/mol��2H2��g��+SO2��g���TS��g��+2H2O��g����H=+90.4kJ/mol
��2H2��g��+CO��g���TCH3OH��g����H=-90.8kJ/mol
��ش�
��1�������仯�����зų��������Ǣ٢ۣ�����ţ���ͬ����
��2��4gH2��g����ȫ��Ӧ���ɼ״�����ʱ����H=-90.8kJ/mol��
��3������1molNH3��g���ķų�������Ϊ46.2kJ��
���� ��1�����ݷ�Ӧ���ʱ�������ʱ�С��0 ��Ӧ���ȣ��ʱ����0��Ӧ�����ȷ�Ӧ��
��2�������Ȼ�ѧ����ʽ�ۼ���õ���
��3�������Ȼ�ѧ����ʽ�ٵĶ�����ϵ���㣮
��� �⣺��1����N2��g��+3H2��g��?2NH3��g����H=-92.4kJ/mol���ʱ�С��0����Ӧ�Ƿ��ȷ�Ӧ��
��2H2��g��+SO2��g��?S��g��+2H2O��g����H=90.4kJ/mol���ʱ����0����Ӧ�����ȷ�Ӧ��
��2H2��g��+CO��g��?CH3OH��g����H=-90.8kJ/mol���ʱ�С��0����Ӧ�Ƿ��ȷ�Ӧ��
�ʴ�Ϊ���٢ۣ�
��2��2H2��g��+CO��g��?CH3OH��g����H=-90.8kJ/mol��
4g H2��g�� ��ȫ��Ӧ���ɼ״�����ʱ����90.8kJ��
�ʴ�Ϊ��-90.8��
��3��N2��g��+3H2��g��?2NH3��g����H=-92.4kJ/mol
����1mol NH3 ��g�� �ķ�Ӧ��Ϊ-46.2KJ/mol���ų�����Ϊ��46.2KJ��
�ʴ�Ϊ��46.2��
���� ���⿼�����Ȼ�ѧ����ʽ����д�����ͼ���Ӧ�ã�ע���ʱ��жϷ�Ӧ�����ı仯����Ŀ�ϼ�

��ϰ��ϵ�д�
 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
�����Ŀ
1����ͼ�ǹ�ҵ������̼��﮵IJ��ֹ������̣����������ͼ����֪��Ϣ�ش����⣮
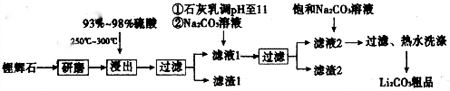
��֪����﮻�ʯ��Ҫ���ΪLi2O•Al2O3•4SiO2����������Ca��MgԪ�أ�
��Li2O•Al2O3•4SiO2+H2SO4��Ũ��$\frac{\underline{\;250-300��\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O��
�ۼ������ʲ�ͬ�¶��µ��ܽ�ȣ�
��1��������1�з����Al2O3�IJ�����������ͼ��ʾ�����ű�ʾ������Լ��������ʾ���õ������ʣ�д��ͼ�Т١��ڡ��۱�ʾ�ĸ����ʣ�����II�з�Ӧ�����ӷ���ʽ��Al3++3NH3•H2O=Al��OH��3��+3NH4+��
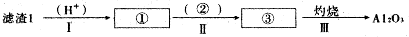
��2����֪����2����Ҫ�ɷ���Mg��OH��2��CaCO3��д����������2��Ӧ�����ӷ���ʽ��Mg2++2OH-=Mg��OH��2����Ca2++CO32-=CaCO3����
��3������Һ2�м��뱥��Na2CO����Һ�����˺��á���ˮϴ�ӡ���ԭ����Li2CO3���ܽ�����¶����߶���С����ˮϴ�ӿɼ���Li2CO3����ʧ��
��4����ҵ�ϣ���Li2CO3��Ʒ�Ʊ��ɸߴ�Li2CO3�IJ��ֹ������£�
�ٽ��ֲ�ƷLi2CO3�����������ý�۵�����Һ��LiOH��Һ������Һ������������ѡ���Ĥ�������ö��Ե缫��⣮�����ĵ缫��Ӧʽ��2C1--2e-=Cl2����
�ڵ������ƷLiOH��Һ�м������NH4HCO����Һ����Li2CO3��Ӧ�Ļ�ѧ����ʽ��2LiOH+2NH4HCO3=Li2CO3+��NH4��2CO3+2H2O��

��֪����﮻�ʯ��Ҫ���ΪLi2O•Al2O3•4SiO2����������Ca��MgԪ�أ�
��Li2O•Al2O3•4SiO2+H2SO4��Ũ��$\frac{\underline{\;250-300��\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O��
�ۼ������ʲ�ͬ�¶��µ��ܽ�ȣ�
| T/�� | 20 | 40 | 60 | 80 |
| S��Li2CO3��/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S��Li2SO4��/g | 34.2 | 32.8 | 31.9 | 30.7 |
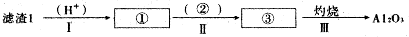
��2����֪����2����Ҫ�ɷ���Mg��OH��2��CaCO3��д����������2��Ӧ�����ӷ���ʽ��Mg2++2OH-=Mg��OH��2����Ca2++CO32-=CaCO3����
��3������Һ2�м��뱥��Na2CO����Һ�����˺��á���ˮϴ�ӡ���ԭ����Li2CO3���ܽ�����¶����߶���С����ˮϴ�ӿɼ���Li2CO3����ʧ��
��4����ҵ�ϣ���Li2CO3��Ʒ�Ʊ��ɸߴ�Li2CO3�IJ��ֹ������£�
�ٽ��ֲ�ƷLi2CO3�����������ý�۵�����Һ��LiOH��Һ������Һ������������ѡ���Ĥ�������ö��Ե缫��⣮�����ĵ缫��Ӧʽ��2C1--2e-=Cl2����
�ڵ������ƷLiOH��Һ�м������NH4HCO����Һ����Li2CO3��Ӧ�Ļ�ѧ����ʽ��2LiOH+2NH4HCO3=Li2CO3+��NH4��2CO3+2H2O��
19��ֱ���ŷź�SO2���������γ����꣬Σ�������������Ƽ�ѭ�������ѳ������е�SO2��
��1���û�ѧ����ʽ��ʾSO2�γ�����������ķ�Ӧ��2SO2+O2+2H2O=2H2SO4��
��2�����Ƽ�ѭ�����У�Na2SO3��Һ��Ϊ����Һ������NaOH��Һ����SO2�Ƶã��÷�Ӧ�����ӷ���ʽ��SO2+2OH-=SO32-+H2O��
��3������Һ����SO2�Ĺ����У�pH��n��SO32-����n��HSO3-���仯��ϵ���±���
���ɱ��жϣ�NaHSO3��Һ�����ԣ��û�ѧƽ��ԭ�����ͣ�HSO3-���ڣ�HSO3-?SO32-+H+��HSO3-+H2O?H2SO3+OH-��HSO3-�ĵ���̶ȴ���ˮ��̶ȣ�
�ڵ�����Һ������ʱ����Һ������Ũ�ȹ�ϵ��ȷ���ǣ�ѡ����ĸ����ab��
a��c��Na+��=2c��SO32-��+c��HSO3-��
b��c��Na+����c��HSO3-����c��SO32-����c��H+��=c��OH-��
c��c��Na+��+c��H+��=c��SO32-��+c��HSO3-��+c��OH-��
��4����2012•�����߿���ѡ����֤��Na2SO3��Һ�д���SO32-+H2O?HSO3-+OH-ˮ��ƽ�����ʵ��C������ţ���
A�������̪��Һ��죬�ټ���H2SO4��Һ���ɫ��ȥ
B�������̪��Һ��죬�ټ�����ˮ���ɫ��ȥ
C�������̪��Һ��죬�ټ���BaCl2��Һ����������Һ�ɫ��ȥ��
��1���û�ѧ����ʽ��ʾSO2�γ�����������ķ�Ӧ��2SO2+O2+2H2O=2H2SO4��
��2�����Ƽ�ѭ�����У�Na2SO3��Һ��Ϊ����Һ������NaOH��Һ����SO2�Ƶã��÷�Ӧ�����ӷ���ʽ��SO2+2OH-=SO32-+H2O��
��3������Һ����SO2�Ĺ����У�pH��n��SO32-����n��HSO3-���仯��ϵ���±���
| n��SO32-����n��HSO3-�� | 91��9 | 1��1 | 9��91 |
| pH | 8.2 | 7.2 | 6.2 |
�ڵ�����Һ������ʱ����Һ������Ũ�ȹ�ϵ��ȷ���ǣ�ѡ����ĸ����ab��
a��c��Na+��=2c��SO32-��+c��HSO3-��
b��c��Na+����c��HSO3-����c��SO32-����c��H+��=c��OH-��
c��c��Na+��+c��H+��=c��SO32-��+c��HSO3-��+c��OH-��
��4����2012•�����߿���ѡ����֤��Na2SO3��Һ�д���SO32-+H2O?HSO3-+OH-ˮ��ƽ�����ʵ��C������ţ���
A�������̪��Һ��죬�ټ���H2SO4��Һ���ɫ��ȥ
B�������̪��Һ��죬�ټ�����ˮ���ɫ��ȥ
C�������̪��Һ��죬�ټ���BaCl2��Һ����������Һ�ɫ��ȥ��
3����NA��ʾ�����ӵ�����������˵������ȷ���ǣ�������
��ͬ�¡�ͬѹ�£���ͬ����ķ��������������ԭ�������
�ڱ�״���£�11.2L�����������ϵĵ���������������ԭ����ΪNA
���ڱ�״���£�22.4L H2O�����ʵ���Ϊ1mol
��4��ʱ5.4mL��ˮ������ԭ������Ϊ0.9NA
��0.1molOH-��0.1NA�����ӣ�
��ͬ�¡�ͬѹ�£���ͬ����ķ��������������ԭ�������
�ڱ�״���£�11.2L�����������ϵĵ���������������ԭ����ΪNA
���ڱ�״���£�22.4L H2O�����ʵ���Ϊ1mol
��4��ʱ5.4mL��ˮ������ԭ������Ϊ0.9NA
��0.1molOH-��0.1NA�����ӣ�
| A�� | �٢ڢ� | B�� | �ڢ� | C�� | �٢ۢܢ� | D�� | �ܢ� |
20������˵������ȷ��һ���ǣ�������
| A�� | H2��D2��Ϊͬλ�� | B�� |  �� �� ��Ϊͬ���칹�� ��Ϊͬ���칹�� | ||
| C�� | ��������춡���ǻ�Ϊͬ���칹�� | D�� | ���Ȼ�̼�ĵ���ʽ |
1�����л�ѧʵ�����ע�ⰲȫ������˵����ȷ���ǣ�������
| A�� | �ƾ���ʵ��̨��ȼ��ʱ����ˮ������� | |
| B�� | ���Թ��е�Һ�����ʱ���Թܿڲ��ܶ��ű��� | |
| C�� | ���ձ���ϡ��Ũ����ʱ��Ӧ��ˮ����ע��Ũ�����У����ò��������� | |
| D�� | ������Ũ����մ��Ƥ���ϣ�Ӧ�ý϶��ˮ��ϴ��Ȼ��Ϳ��������Һ |