题目内容
14.下列各项中正确的是( )| A. |  中所有碳原子可能在同一平面上 中所有碳原子可能在同一平面上 | |
| B. | 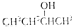 的命名为2-甲基-1-丙醇 的命名为2-甲基-1-丙醇 | |
| C. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | |
| D. | C4H8属于烯烃的同分异构体共有4种(含顺反异构) |
分析 A.甲烷是正四面体结构;
B.醇类命名选取含有羟基的最长碳链为主链;
C.聚氯乙烯中不含有碳碳双键,苯分子中不含有碳碳双键;
D.烯烃具有顺反异构,C=C双键不饱和的同一C原子上连接2个不同的原子或原子团,据此书写判断.
解答 解:A.甲烷是正四面体结构,与甲基相连的饱和碳原子与周围的3个碳不在同一平面上,故A错误;
B.醇类命名选取含有羟基的最长碳链为主链,即为丁醇,在2号碳上含有羟基,正确命名为:2-丁醇,故B错误;
C.聚氯乙烯的结构简式为: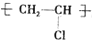 ,聚氯乙烯中不含碳碳双键,苯中不含有碳碳双键,故C错误;
,聚氯乙烯中不含碳碳双键,苯中不含有碳碳双键,故C错误;
D.C4H8中属于烯烃的同分异构体有CH2═CH-CH2CH3、CH2=C(CH3)2、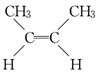 、
、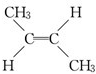 ,故符合条件的同分异构体有4种,故D正确.
,故符合条件的同分异构体有4种,故D正确.
故选D.
点评 本题考查有机物的结构、命名、同分异构体的书写,难度不大,注意烯烃具有顺反异构,满足C=C双键不饱和的同一C原子上连接2个不同的原子或原子团.

练习册系列答案
相关题目
5.下列各组有机物不是同分异构体的是( )
| A. | CH3CH2CH2OH和CH3-O-CH2CH3 | B. |  | ||
| C. |  和CH3(CH2)2CHO 和CH3(CH2)2CHO | D. |  |
9.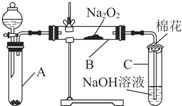 为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:
为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:
(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃,甲同学因此认为SO2与Na2O2的反应不同于CO2.请按甲同学的观点写出反应的化学方程式SO2+Na2O2=Na2SO4.
(2)乙同学认为无论反应原理如何,最终都有O2产生,乙同学的理由是A中生成的SO2气体中含有水蒸气.按照乙同学的观点,该装置需做的改进是在A和B之间连接一个装有浓硫酸的洗气瓶.
(3)假设Na2O2完全反应,反应后B装置中固体生成物可能是:①Na2SO3;②Na2SO4;③Na2SO3和Na2SO4.
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成表:
限选试剂:2mol•L-1 HCl溶液,1mol•L-1 HNO3溶液,1mol•L-1 BaCl溶液,1mol•L-1 Ba(NO3)2溶液,0.01mol•L-1 KMnO4酸性溶液.
(4)生成物中亚硫酸钠含量的测定:
①取a g生成物配制成100mL溶液,取10.00mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,用0.010 0mol•L-1碘水进行滴定,滴定终点现象为溶液出现蓝色,且半分钟内不褪色.记录数据,重复滴定2次,平均消耗碘水20.00mL.
②计算:生成物中亚硫酸钠的质量分数为$\frac{0.252}{a}$×100%.
 为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:
为了探究SO2与Na2O2的反应是否类似于CO2与Na2O2的反应,甲同学设计了如图所示的实验装置,回答下列问题:(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃,甲同学因此认为SO2与Na2O2的反应不同于CO2.请按甲同学的观点写出反应的化学方程式SO2+Na2O2=Na2SO4.
(2)乙同学认为无论反应原理如何,最终都有O2产生,乙同学的理由是A中生成的SO2气体中含有水蒸气.按照乙同学的观点,该装置需做的改进是在A和B之间连接一个装有浓硫酸的洗气瓶.
(3)假设Na2O2完全反应,反应后B装置中固体生成物可能是:①Na2SO3;②Na2SO4;③Na2SO3和Na2SO4.
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成表:
限选试剂:2mol•L-1 HCl溶液,1mol•L-1 HNO3溶液,1mol•L-1 BaCl溶液,1mol•L-1 Ba(NO3)2溶液,0.01mol•L-1 KMnO4酸性溶液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中 | 固体完全溶解 |
| 步骤2:往Ⅰ试管中加入1mol•L-1盐酸,再滴加1mol•L-1BaCl2溶液 | 有白色沉淀生成,则证明生成物中含Na2SO4, |
| 则证明生成物中含Na2SO4 | |
| 步骤3:往Ⅱ试管中加入2~3滴0.01mol•L-1KMnO4酸性溶液, | |
| 振荡 | 若KMnO4溶液紫红色褪去,则证明生成物中有Na2SO3;, |
| 则证明生成物中有Na2SO3;若 | |
| 若KMnO4溶液紫红色不褪去, | |
| 则说明生成物中没有Na2SO3. |
①取a g生成物配制成100mL溶液,取10.00mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,用0.010 0mol•L-1碘水进行滴定,滴定终点现象为溶液出现蓝色,且半分钟内不褪色.记录数据,重复滴定2次,平均消耗碘水20.00mL.
②计算:生成物中亚硫酸钠的质量分数为$\frac{0.252}{a}$×100%.
19.直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:2SO2+O2+2H2O=2H2SO4.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是SO2+2OH-=SO32-+H2O.
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
①由表判断,NaHSO3溶液显酸性,用化学平衡原理解释:HSO3-存在:HSO3-?SO32-+H+和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度.
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab.
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)(2012•福建高考节选)能证明Na2SO3溶液中存在SO32-+H2O?HSO3-+OH-水解平衡的事实是C(填序号).
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:2SO2+O2+2H2O=2H2SO4.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是SO2+2OH-=SO32-+H2O.
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab.
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)(2012•福建高考节选)能证明Na2SO3溶液中存在SO32-+H2O?HSO3-+OH-水解平衡的事实是C(填序号).
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去.
3.用NA表示阿伏加德罗常数,下列说法中正确的是( )
①同温、同压下,相同体积的氟气和氩气所含的原子数相等
②标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA
③在标准状况下,22.4L H2O的物质的量为1mol
④4℃时5.4mL的水所含的原子总数为0.9NA
⑤0.1molOH-含0.1NA个电子.
①同温、同压下,相同体积的氟气和氩气所含的原子数相等
②标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA
③在标准状况下,22.4L H2O的物质的量为1mol
④4℃时5.4mL的水所含的原子总数为0.9NA
⑤0.1molOH-含0.1NA个电子.
| A. | ①②③ | B. | ②④ | C. | ①③④⑤ | D. | ④⑤ |
4.若甲苯的苯环上有2个氢原子同时被1个羟基(-OH)和1个氯原子(-Cl)取代,则可形成的有机物同分异构体有( )
| A. | 9种 | B. | 10种 | C. | 12种 | D. | 15种 |
 .
.