题目内容
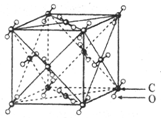
20.已知,金刚石的燃烧热为395kJ/mol,下表是部分化学键的键能数据,下列选项中正确的是:| 化学键 | C-C | O=O | C=O |
| 键能(kJ/mol) | 348 | 498 | x |
| A. | X=794.5 | |
| B. | X=1142.5 | |
| C. | 1mol金刚石的能量一定比1molCO2能量高 | |
| D. | 金刚石燃烧的热化学方程式为2C(s)+O2(g)=2CO(g)△H=790kJ/mol |
分析 A、B、金刚石燃烧的方程式为C+O2=CO2,根据化学键的断裂和形成的数目进行计算x;
C、因为金刚石的燃烧热为395kJ/mol,则根据能量守恒,则1mol金刚石的能量和1mol氧气的能量之和比1molCO2能量高395kJ判断;
D、根据金刚石的燃烧热为395kJ/mol书写热化学方程式为C(s)+O2(g)=CO2(g)△H=-395kJ/mol.
解答 解:A、B、金刚石燃烧的方程式为C+O2=CO2,因为在金刚石结构中平均1mol碳形成2mol碳碳单键,所以1mol金刚石完全燃烧需拆开2mol C-C、1mol O=O,形成2molC=O,所以2molx-2mol×348kJ/mol-1mol×498kJ/mol=395kJ,解得x=794.5KJ,故A正确,B错误;
C、因为金刚石的燃烧热为395kJ/mol,则根据能量守恒,则1mol金刚石的能量和1mol氧气的能量之和比1molCO2能量高395kJ,但不能确定1mol金刚石的能量一定比1molCO2能量高,故C错误;
D、因为金刚石的燃烧热为395kJ/mol,所以金刚石燃烧的热化学方程式为C(s)+O2(g)=CO2(g)△H=-395kJ/mol,故D错误;
故选:A.
点评 本题考查热化学方程式的书写方法和计算应用,注意焓变和键能之间的关系,特别是注意分析金刚石的结构,正确判断共价键的数目是计算难点,学习中要准确把握.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
10.去年下半年我省雾霾天气十分严重.PM2.5细颗粒物含有的毒性物质来源之一是汽车尾气排放.通过排气管加装催化装置,可有效减少CO和NO的排放,催化装置内发生的反应为:NOx+CO$\stackrel{催化剂}{→}$N2+CO2,下列关于此反应的说法中,不正确的是( )
| A. | 所涉及元素的第一电离能:N>O>C | |
| B. | 当x=2时,每生成1molN2,转移电子数为4mol | |
| C. | 等物质的量N2和C02中,π键的个数比为1:1 | |
| D. | 氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
8. 如图为实验室制氢气的简单装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )
如图为实验室制氢气的简单装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )
①食盐水 ②KNO3溶液 ③乙醇 ④Na2CO3溶液 ⑤CCl4 ⑥浓氨水.
 如图为实验室制氢气的简单装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )
如图为实验室制氢气的简单装置.若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )①食盐水 ②KNO3溶液 ③乙醇 ④Na2CO3溶液 ⑤CCl4 ⑥浓氨水.
| A. | ①③⑤ | B. | ②⑥ | C. | ③⑤ | D. | ①②④ |
12.将下列离子方程式改写成化学方程式,正确的是( )
| A. | Cu2++2OH-═Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+═H2O+CO2↑ BaCO3+2HCl═BaCl2+H2O+CO2↑ | |
| C. | Ca2++CO32-═CaCO3↓ Ca(OH)2+K2CO3═CaCO3↓+2KOH | |
| D. | H++OH-═H2O Ba(OH)2+H2SO4═BaSO4+2H2O |
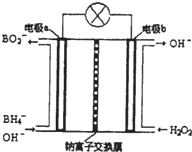 硼氢化钠(NaBH4)是有机合成中的重要还原剂,最新研究发现,以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题:
硼氢化钠(NaBH4)是有机合成中的重要还原剂,最新研究发现,以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题: