题目内容
7.向含有5×10-3mol HIO3与少量淀粉的溶液中通入H2S,溶液变蓝且有S析出,继续通入H2S,溶液的蓝色褪去.则在整个过程中( )| A. | 共得到0.96g硫 | B. | 通入H2S的体积为336mL | ||
| C. | 硫元素先被还原后被氧化 | D. | 转移电子总数为3.0×10-2NA |
分析 HIO3与少量淀粉的溶液中通入H2S,HIO3具有氧化性,能将硫化氢氧化生成硫单质和碘单质,所以溶液变蓝且有S析出,继续通入H2S,会和碘单质之间发生反应,碘单质消失,所以溶液的蓝色褪去.
解答 解:A、HIO3与少量淀粉的溶液中通入H2S,HIO3具有氧化性,能将硫化氢氧化生成硫单质和碘单质,所以溶液变蓝且有S析出,根据电子守恒、原子守恒,得到2HIO3~5H2S~5S,所以5×10-3molHIO3被消耗,就会得到硫单质是$\frac{5×1{0}^{-3}×5}{2}$×32g=0.4g,故A错误;
B、整个过程中,根据电子守恒、原子守恒,得到HIO3~3H2S~3S~I-,所以5×10-3molHIO3被消耗,就会消耗0.015mol的H2S,标况下体积为336mL,故B正确;
C、HIO3与少量淀粉的溶液中通入H2S,HIO3具有氧化性,能将硫化氢氧化生成硫单质和碘单质,H2S被氧化,继续通入H2S,会和碘单质之间发生反应,碘单质消失,H2S被氧化,故C错误;
D、整个过程中,根据电子守恒、原子守恒,得到HIO3~3H2S~3S~I-~6e-,消耗5×10-3molHIO3伴随0.03mol电子转移,转移电子总数为3.0×10-2NA,故D正确.
故选BD.
点评 本题考查学生氧化还原反应中的电子守恒的计算知识,注意知识的迁移应用是关键,难度不大.

练习册系列答案
相关题目
17.分析生产生活中的下列过程,不涉及氧化还原反应的是( )
| A. | 煤液化制得清洁能源 | B. | 用酒精测试仪检测酒驾 | ||
| C. | 将氯气通入冷的消石灰中制漂白粉 | D. | 从海水中提取氯化镁 |
15.常温下,向amol•L-1某弱酸HA溶液中滴加等体积的bmol•L-1氢氧化钠溶液恰好使溶液呈中性,该温度下,HA的电离常数表达式为 ( )
| A. | $\frac{b}{(a+b)×1{0}^{7}}$ | B. | $\frac{b}{(a-b)×1{0}^{7}}$ | C. | $\frac{b}{(a-b)×1{0}^{5}}$ | D. | $\frac{a-b}{a×1{0}^{7}}$ |
2.离子晶体一般不具有的特征是( )
| A. | 熔点较高,硬度较大 | B. | 易溶于水而难溶于有机溶剂 | ||
| C. | 固体时不能导电 | D. | 离子间距离较大,其密度较小 |
12. 下列所列各组物质中,物质之间通过一部步反应不能实现如图所示转化的是( )
下列所列各组物质中,物质之间通过一部步反应不能实现如图所示转化的是( )
 下列所列各组物质中,物质之间通过一部步反应不能实现如图所示转化的是( )
下列所列各组物质中,物质之间通过一部步反应不能实现如图所示转化的是( ) | 选项 | a | b | c |
| A | Al2O3 | Na[Al(OH)4] | Al(OH)3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | Fe | FeCl3 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
2.下列说法或有关化学用语的表达正确的是( )
| A. | CO2的电子式: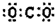 | |
| B. | 基态Fe原子的外围电子排布图为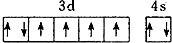 | |
| C. | 在基态多电子原子中,P轨道电子能量一定高于s轨道电子能量 | |
| D. | 根据原子核外电子排布的特点,Cu在元素周期表中位于s区 |
3.设NA是阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| B. | 28克由C3H6和C4H8组成的混合气体中含共用电子对数目为6NA个 | |
| C. | 0.1mol氧气作为氧化剂得到电子的数目一定为0.4NA | |
| D. | 常温下,0.1mol•L-1的碳酸钠溶液中含有的阴离子数大于0.1NA |
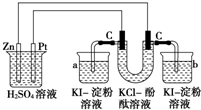 按照如图接通线路,反应一段时间后,回答下列问题(假设所提供的电能可以保证电解反应的顺利进行):
按照如图接通线路,反应一段时间后,回答下列问题(假设所提供的电能可以保证电解反应的顺利进行):