题目内容
2.Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+?2Fe2++I2(水溶液)(1)在一定温度下,测得2min内生成I2的物质的量浓度为0.02mol/L,则用Fe3+表示该反应在这2min内平均反应速率为0.02mol•L-1•min-1.
(2)假设c(I-)由0.1mol/L降到0.07mol/L需15s,那么c(I-)由0.07mol/L降到0.05mol/L,所需反应的时间为大于10s(填“大于”、“小于”或“等于”)
(3)上述反应的正反应速率和I-、Fe3+的物质的量浓度关系为:ν=k{c(I-)}m{c(Fe3+)}n(k为常数)
| C(I-)/(mol•L-1) | C(Fe3+)/(mol•L-1) | ν/(mol•(L•s)-1) | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
A.m=1,n=1 B.m=1,n=2 C.m=2,n=1 D.m=2,n=2
(4)I-物质的量浓度对反应速率的影响大于(填“大于”、“小于”或“等于”)Fe3+物质的量浓度对反应速率的影响.
分析 (1)反应速率v=$\frac{△c}{△t}$,先计算I2速率,反应速率之比等于化学方程式计量数之比计算得到Fe3+表示的反应速率;
(2)若c(HI)由0.1mol/L 降到0.07mol/L时,需要15s,即减少0.03mol/L需要15s;c(HI)由0.07mol/L 降到0.05mol/L时,浓度减少0.02mol/L,当速率与浓度变化成正比时,需要10s,但浓度越小,化学反应速率越小,需要的时间就长,以此来解答;
(3)将表中的三组数据代入公式v=k[c(I-)]m•[c(Fe3+)]n得m和n的值;
(4)依据(3)计算得到数值判断对反应速率的影响大小.
解答 解:(1)测得2min内生成I2的物质的量浓度为0.02mol/L,v(I2)=$\frac{0.02mol/L}{2min}$=0.01mol/L•min,则用Fe3+表示该反应在这2min内平均反应速率v(Fe3+)=2v(I2)=0.02 mol•L-1•min-1,
故答案为:0.02 mol•L-1•min-1;
(2)若c(HI)由0.1mol/L 降到0.07mol/L时,需要15s,即减少0.03mol/L需要15s;
c(HI)由0.07mol/L 降到0.05mol/L时,浓度减少0.02mol/L,
当速率与浓度变化成正比时,需要$\frac{0.02mol/L}{0.03mol/L}$×15s=10s,
但浓度越小,化学反应速率越小,需要的时间就长,
所以需要时间大于10s,
故答案为:大于;
(3)将表中的三组数据代入公式v=k[c(I-)]m•[c(Fe3+)]n
得0.20m×0.80n=0.032K,
0.60m×0.40n=0.144K,
0.80m×0.20n=0.128K,
解之得:m=2,n=1,
故答案为:C;
(4)上述计算和速率方程可知,I-浓度对反应速率的影响大,I-物质的量浓度对反应速率的影响大于Fe3+物质的量浓度对反应速率的影响,
故答案为:大于.
点评 本题考查了了化学平衡常数、反应速率概念的计算,注意对表格中数据的处理,掌握基础是关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 乙烯与HBr发生加成反应 | B. | 苯发生硝化反应 | ||
| C. | 乙烯合成聚乙烯 | D. | 乙醇催化氧化生成乙醛 |
【实验1】甲同学用8.00mL 0.001mol/L KMnO4溶液与5.00mL 0.01mol/LH2C2O4溶液反应,研究不同条件对化学反应速率的影响.改变的条件如下:
| 组别 | KMnO4溶液 /ml | H2C2O4溶液 /ml | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 8.00 | 5.00 | 3.00 | 20 | |
| Ⅱ | 8.00 | 5.00 | 3.00 | 30 | |
| Ⅲ | 8.00 | 5.00 | 1.00 | 20 | 2.00 mL 蒸馏水 |
(2)对比实验Ⅰ和Ⅲ,可以研究c(H+)(或硫酸溶液的浓度)对化学反应速率的影响,实验Ⅲ中加入2.00mL蒸馏水的目的是确保实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,可使Ⅰ和Ⅲ中硫酸浓度不同.
【实验2】乙同学在研究草酸与高锰酸钾在酸性条件下反应的影响因素时发现,草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.
(1)针对上述现象,乙同学认为草酸与高锰酸钾反应放热,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是催化剂的影响.
(2)若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是D(填字母).A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰.
| A. | 随着元素原子序数的递增,原子最外层电子总是从1到8重复出现 | |
| B. | 随着元素原子序数的递增,原子半径从大到小(稀有气体除外)发生周期性变化 | |
| C. | 随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 | |
| D. | 元素性质的周期性变化是指原子核外电子排布的周期性变化、原子半径的周期性变化 |
| A. | KCl | B. | NaF | C. | Na2O | D. | NaCl |
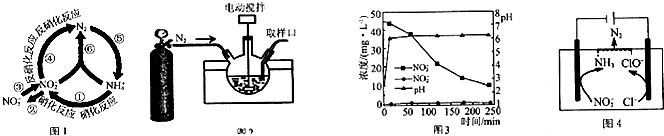
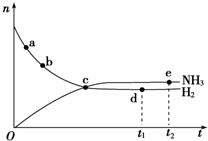
 某可逆反应在某体积为5L的密闭容器中进行,在从0~3分钟各物质的量的变化情况如图所示(A,B,C均为气体),该反应的化学方程式为2A+B?2C.
某可逆反应在某体积为5L的密闭容器中进行,在从0~3分钟各物质的量的变化情况如图所示(A,B,C均为气体),该反应的化学方程式为2A+B?2C. 氮的化合物在无机化工领域有着重要的地位.请回答下列问题:
氮的化合物在无机化工领域有着重要的地位.请回答下列问题:
 氮是重要的非金属元素,单质用途之一是制取氨气,反应方程式为:
氮是重要的非金属元素,单质用途之一是制取氨气,反应方程式为: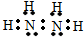 该反应的化学方程式为N2H4+2H2O2=N2↑+4H2O.
该反应的化学方程式为N2H4+2H2O2=N2↑+4H2O.