题目内容
5.在水体中部分含氮有机物循环如图1所示.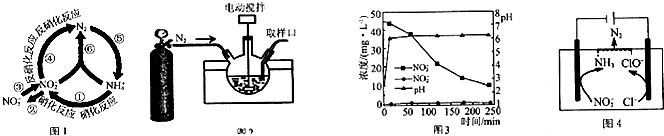
(1)图中属于氮的固定的是⑤(填序号).
(2)图中①②的转化是在亚硝化细菌和硝化细菌作用下进行的,已知:
2NH4+(aq)+3O2═2NO2-(aq)+4H+(aq)+2H2O(l)△H1=-556.8kj/mol
2NO2-(aq)+O2(g)=2NO3-(aq);△H2=-145.2KJ•mol-1
则反应NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(1);
△H3=-351KJ•mol-1
(3)某科研机构研究通过化学反硝化的方法除脱水体中过量的NO3-,他们在图示的三颈烧瓶中(装置如图2)中,加入NO3-起始浓度为45mg•L-1的水样、自制的纳米铁粉,起始时pH=2.5,控制水浴温度为25℃、搅拌速率为500转/分,实验中每间隔一定时间从取样口检测水体中NO3-、NO2-及pH(NH4+、N2未检测)的相关数据(如图3).
①实验室可通过反应Fe(H2O)62++2BH4-=Fe↓+2H3BO3+7H2↑制备纳米铁粉,每生成1molFe转移电子总的物质的量为8mol.
②向三颈烧瓶中通入N2的目的是排除装置中的空气,防止铁粉被氧气氧化干扰测定结果.
③开始反应0~20min,pH快速升高到约6.2,原因之一是NO3-还原为NH4+及少量在20~250min时,加入缓冲溶液维持pH6.2左右,NO3-主要还原为NH4+,Fe转化为Fe(OH)2,该反应的离子方程式为4Fe+NO3-+5H2O+2H+=4Fe(OH)2+NH4+.
(4)一种可以降低水体中NO3-含量的方法是:在废水中加入食盐后用特殊电极进行电解反硝化脱除,原理可用图4简要说明.
①电解时,阴极的电极反应式为NO3-+6H2O+8e-=NH3+9OH-.
②溶液中逸出N2的离子方程式为2NH3+3ClO-=N2+3Cl-+3H2O.
分析 (1)将游离态的氮(即氮气)转化为化合态的氮(即氮的化合物)的过程,叫做氮的固定;
(2)①2NH4+(aq)+3O2═2NO2-(aq)+4H+(aq)+2H2O(l)△H1=-556.8kj/mol
②2NO2-(aq)+O2(g)=2NO3-(aq);△H2=-145.2KJ•mol-1
依据盖斯定律计算(①+②)×$\frac{1}{2}$得到反应NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(1)热化学方程式;
(3)①反应Fe(H2O)62++2BH4-=Fe↓+2H3BO3+7H2↑,反应中铁元素化合价+2价降低为0价,B元素化合价为+3价,元素化合价不变,氢元素化合价-1价升高为0价,生成1molFe电子转移8mol;
②加入缓冲溶液维持pH6.2左右,NO3-主要还原为NH4+,Fe转化为Fe(OH)2,铁消耗氢离子发生腐蚀,酸性溶液中硝酸根离子氧化亚铁离子生成氢氧化亚铁,硝酸根离子被还原为铵根离子,结合电荷守恒和原子守恒配平书写离子方程式;
(4)①电解池中阴极上是NO3-被还原为NH3,失电子发生还原反应;
②氨气被次氯酸根离子氧化生成氮气,结合电荷守恒和原子守恒配平书写离子方程式.
解答 解:(1)分析转化关系可知,氮的固定是指单质变化为化合物的反应,所以图中属于氮的固定的是⑤,
故答案为:⑤;
(2)①2NH4+(aq)+3O2═2NO2-(aq)+4H+(aq)+2H2O(l)△H1=-556.8kj/mol
②2NO2-(aq)+O2(g)=2NO3-(aq);△H2=-145.2KJ•mol-1
依据盖斯定律计算(①+②)×$\frac{1}{2}$得到反应NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(1)△H3=-351KJ/mol,
故答案为:-351;
(3)①反应Fe(H2O)62++2BH4-=Fe↓+2H3BO3+7H2↑,反应中铁元素化合价+2价降低为0价,B元素化合价为+3价,元素化合价不变,氢元素化合价-1价升高为0价,生成1molFe电子转移8mol,
故答案为:8mol;
②加入缓冲溶液维持pH6.2左右,NO3-主要还原为NH4+,Fe转化为Fe(OH)2,铁消耗氢离子发生腐蚀,酸性溶液中硝酸根离子氧化亚铁离子生成氢氧化亚铁,硝酸根离子被还原为铵根离子,结合电荷守恒和原子守恒配平书写离子方程式为:4Fe+NO3-+5H2O+2H+=4Fe(OH)2+NH4+,
故答案为:4Fe+NO3-+5H2O+2H+=4Fe(OH)2+NH4+;
(4)①电解池中阴极上是NO3-被还原为NH3,失电子发生还原反应,电极反应为NO3-+6H2O+8e-=NH3+9OH-,
故答案为:NO3-+6H2O+8e-=NH3+9OH-;
②氨气被次氯酸根离子氧化生成氮气,反应的离子方程式为:2NH3+3ClO-=N2+3Cl-+3H2O,
故答案为:2NH3+3ClO-=N2+3Cl-+3H2O.
点评 本题考查了含氮物质性质、氧化还原反应、电解池原理分析、热化学方程式书写,主要是题干信息的理解应用,掌握基础是解题关键,题目难度较大.

 名校课堂系列答案
名校课堂系列答案| A. | PbCO3 | B. | 2PbCO3•Pb(OH)2 | C. | Pb(OH)2 | D. | (CH3COO)2Pb |
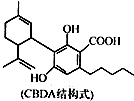
| A. | 1个CBDA分子中含有2个手性碳原子 | |
| B. | 1 mol CBDA 最多可与2molBr2反应 | |
| C. | 1 mol CBDA最多可与3 mol NaHCO3反应 | |
| D. | 1 mol CBDA最多可与2mol H2发生加成反应 |
| A. | 1.2mol/L | B. | 1.4mol/L | C. | 1.7mol/L | D. | 1.9mol/L |
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如下的方案.
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | 溶液颜色褪至无色所需时间/s | ||
| 浓度 /mol•L-1 | 体积 /mL | 浓度 /mol•L-1 | 体积 /mL | |||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 | t1 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 | t2 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 | t3 |
(2)探究温度对化学反应速率影响的实验编号是②和③(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是①和②.
(3)实验①测得KMnO4溶液的褪色时间t1为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=0.010或1.0×10-2 mol•L-1•min-1.
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图1.若保持其他条件不变,请在答题卡坐标图中,画出25℃时c(MnO4-)~t的变化曲线示意图.
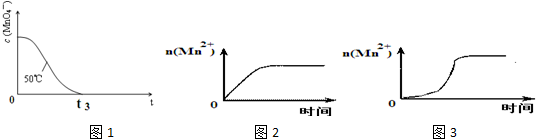
(5)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图2所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图3所示.该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 /℃ | 再向试管中加入少量固体 | 溶液颜色褪至无色所需时间/s | ||
| 浓度 /mol•L-1 | 体积 /mL | 浓度 /mol•L-1 | 体积 /mL | ||||
| ④ | 0.10 | 2.0 | 0.010 | 4.0 | 25 | MnSO4 | t4 |
(1)在一定温度下,测得2min内生成I2的物质的量浓度为0.02mol/L,则用Fe3+表示该反应在这2min内平均反应速率为0.02mol•L-1•min-1.
(2)假设c(I-)由0.1mol/L降到0.07mol/L需15s,那么c(I-)由0.07mol/L降到0.05mol/L,所需反应的时间为大于10s(填“大于”、“小于”或“等于”)
(3)上述反应的正反应速率和I-、Fe3+的物质的量浓度关系为:ν=k{c(I-)}m{c(Fe3+)}n(k为常数)
| C(I-)/(mol•L-1) | C(Fe3+)/(mol•L-1) | ν/(mol•(L•s)-1) | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
A.m=1,n=1 B.m=1,n=2 C.m=2,n=1 D.m=2,n=2
(4)I-物质的量浓度对反应速率的影响大于(填“大于”、“小于”或“等于”)Fe3+物质的量浓度对反应速率的影响.

 .
.