题目内容
1.一定温度下定容密闭容器中,对可逆反应A(g)+2B(g)?3C(g) 的下列叙述中,能说明反应已达到平衡的是( )| A. | B的消耗速率与B的生成速率相等 | |
| B. | 单位时间内消耗3a mol C,同时生成a mol A | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体的密度不再变化 |
分析 可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.B的消耗速率与B的生成速率相等,即正逆反应速率相等,反应达到平衡状态,故A正确;
B.无论反应是否达到平衡状态,都存在单位时间内消耗3a mol C,同时生成a mol A,不能据此判断平衡状态,故B错误;
C.反应前后气体的计量数之和不变,则恒温恒容条件下,无论反应是否达到平衡状态,容器内压强始终不变,不能据此判断平衡状态,故C错误;
D.反应前后气体的总质量不变,容器体积不变,则容器内气体密度始终不变,不能据此判断平衡状态,故D错误;
故选A.
点评 本题考查化学平衡状态判断,为高频考点,只有反应前后改变的物理量才能作为平衡状态判断依据,也可以根据反应速率判断但反应方向必须相反,题目难度不大.

练习册系列答案
相关题目
11.在t℃时,Agl在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgBr的Ksp=5×10-13,下列说法不正确的是( )
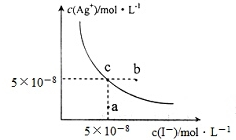

| A. | 在t℃时,Agl的Ksp=2.5×10-15 | |
| B. | 图中b点有碘化银晶体析出 | |
| C. | 向c点溶液中加入适量蒸馏水,可使溶液由c点到a点 | |
| D. | 在t℃时,反应AgBr(s)+I-(aq)?Agl(s)+Br-(aq)的平衡常数K=200 |
9.T℃时在2L刚性密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积分数φ(Y)与时间的关系如图2所示.则下列结论错误的是( )
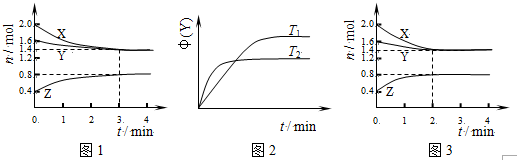

| A. | 容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | |
| B. | 反应进行的前3min内,用X表示的反应速率v(X)=0.2mol•(L•min)-1 | |
| C. | 保持其他条件不变,升高温度,反应的化学平衡常数K减小 | |
| D. | 其它条件不变,使用催化剂,则反应进程可能如图3所示 |
6.推理在问题解决过程中常涉及到.同学们要学会从实验数据、物质已知的性质、题给信息等各种渠道收集证据,对物质的性质及其变化提出可能的假设;基于这些证据进行分析推理,最后形成科学结论.
(一) 有无色溶液,可能含有K+、SO42-、CO32-、NH4+、Cl-、Ba2+、Cu2+中的一种或几种,按以下步骤进行实验:
①取100ml溶液往其中加入足量稀硫酸,有0.224L(标况下)气体产生;
②另取100ml溶液滴加足量Ba(NO3)2溶液,有4.2g白色沉淀生成
③继续向②中的溶液滴加足量NaOH溶液并加热,产生刺激性气味的气体0.672L(标况下);
根据以上事实判断:
(1)肯定存在的是CO32-、SO42-、NH4+、K+;
(2)肯定不存在的是Cu2+,Ba2+;
(3)不能确定是否存在的是Cl-.请简述证明该物质是否存在的实验方案(实验方法、现象、结论)将②所得混合物过滤,向滤液中加入硝酸酸化的硝酸银,若产生白色沉淀,证明原溶液中含有氯离子,否则不含氯离子
(二).某学习小组设计以下四个实验探究氯水的成分,请根据表回答问题.
(1)实验①和实验④得出的结论
①氯水中含有Cl-,④氯水中含有H+.
(2)指出实验②中的“实验现象”为紫色石蕊先变红后褪色.
(3)实验③中的离子反应方程式Cl2+2I-=2Cl-+I2.
(一) 有无色溶液,可能含有K+、SO42-、CO32-、NH4+、Cl-、Ba2+、Cu2+中的一种或几种,按以下步骤进行实验:
①取100ml溶液往其中加入足量稀硫酸,有0.224L(标况下)气体产生;
②另取100ml溶液滴加足量Ba(NO3)2溶液,有4.2g白色沉淀生成
③继续向②中的溶液滴加足量NaOH溶液并加热,产生刺激性气味的气体0.672L(标况下);
根据以上事实判断:
(1)肯定存在的是CO32-、SO42-、NH4+、K+;
(2)肯定不存在的是Cu2+,Ba2+;
(3)不能确定是否存在的是Cl-.请简述证明该物质是否存在的实验方案(实验方法、现象、结论)将②所得混合物过滤,向滤液中加入硝酸酸化的硝酸银,若产生白色沉淀,证明原溶液中含有氯离子,否则不含氯离子
(二).某学习小组设计以下四个实验探究氯水的成分,请根据表回答问题.
| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
| ② | 将氯水滴加到紫色石蕊试液中 | 氯水中不仅有H+还有HClO | |
| ③ | 将氯水滴加到淀粉-KI试纸上 | 淀粉-KI试纸变蓝 (I2遇淀粉变蓝) | 氯水中有Cl2 |
| ④ | 将足量的氯水滴加到NaHCO3溶液中 | 有气泡生成 |
①氯水中含有Cl-,④氯水中含有H+.
(2)指出实验②中的“实验现象”为紫色石蕊先变红后褪色.
(3)实验③中的离子反应方程式Cl2+2I-=2Cl-+I2.
13.“纳米材料”是当今材料科学研究的前沿,1纳米(nm)=10-9m,其研究成果广泛应用于催化及军事科学中.“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料,如将“纳米材料”分散到液体分散剂中,所得混合物属于下列分散系中的( )
| A. | 溶液 | B. | 悬浊液 | C. | 乳浊液 | D. | 胶体 |
10.某探究小组在某温度下,测得溶液的PH时发现:0.01mol•L-1的NaHSO4溶液中,由水电离出的 C(H+)•C(OH-)=10-20.在该温度下,将V1 L PH=4的NaHSO4溶液与V2L PH=9的Ba(OH)2溶液混合(忽略溶液体积变化),所得溶液PH=7,则V1:V2等于( )
| A. | 9:1 | B. | 10:1 | C. | 1:10 | D. | 9:2 |
11.下列依据热化学方程式得出的结论正确的是( )
| A. | 若2CH3OH(1)+3O2(g)═2CO2(g)+2H2O(g)△H=-1478KJ/mol,则CH3OH(1)的燃烧热为739KJ/mol | |
| B. | 若P4(白磷,s)═4P(红磷,s)△H<0,则红磷比白磷稳定 | |
| C. | 已知H+(aq)+OH-(aq)═H2O(1)△H=-57.3KJ/mol,则20.0g NaOH固体与稀盐酸完全中和,放出28.65KJ的热量 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1; 2C(s)+O2(g)=2CO(g)△H2;△H1>△H2 |
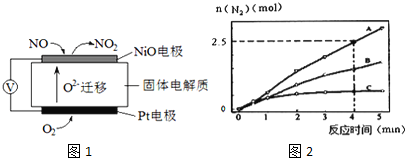
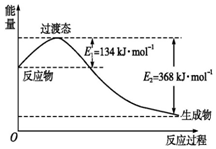 写出下列反应的热化学方程式
写出下列反应的热化学方程式